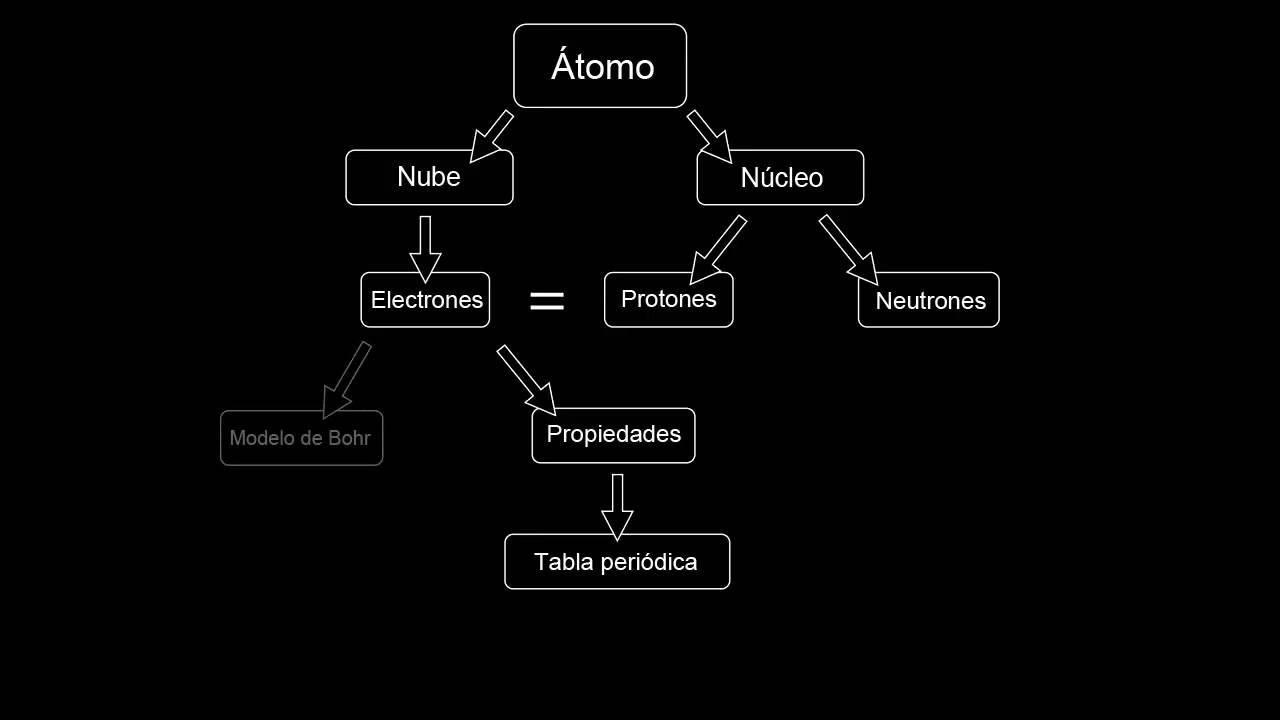
El போர் அணு மாதிரி ஒரு அணுவிற்குள் தனிமங்கள் எவ்வாறு அமைக்கப்பட்டிருக்கின்றன என்பதை விளக்க முயற்சிக்கவும். அதன் மூலம், வட்டப்பாதையில் அணுக்களின் இயக்கம் மற்றும் ஒரு சுற்றுப்பாதைக்கும் மற்றொன்றுக்கும் இடையில் அவற்றின் இடப்பெயர்ச்சி ஆகியவை ஆற்றல் அதிகரிப்பு அல்லது இழப்புகளை உருவாக்கும் திறன் கொண்டவை என்பதை ஊகிக்க முடிந்தது. இங்கே நீங்கள் பற்றி மேலும் அறியலாம் B இன் அணுக் கோட்பாடுஓ.

அணு போர் மாதிரி
இது ரதர்ஃபோர்ட்-போர் என்ற மாதிரி பெயரையும் பெற்றது. இது 1913 இல் ரூதர்ஃபோர்டின் மாதிரியை அடிப்படையாகக் கொண்டு உருவாக்கப்பட்டது, இது வெற்றிகரமான மற்றும் புரட்சிகரமானதாக இருந்தாலும், மேக்ஸ்வெல்லின் விதிகள் மற்றும் நியூட்டனின் விதிகளுடன் சில முரண்பாடுகளைக் கொண்டிருந்தது, ஏனெனில் அனைத்து அணுக்களும் நிலையற்றவை என்ற கருத்தில் வந்தது.
மின்காந்தவியல் விதிகளின்படி, எதிர்மறை மின்னேற்றத்தைக் கொண்ட நகரும் எலக்ட்ரான்கள் மின்காந்தக் கதிர்வீச்சைப் பரப்ப வேண்டும் என்ற உண்மையை அடிப்படையாகக் கொண்டது ரதர்ஃபோர்டின் அணு மாதிரி. இது அவ்வாறு இருப்பதாகக் கருதினால், ஆற்றல் இழப்பு எலக்ட்ரான்கள் அவற்றின் சுற்றுப்பாதையை சுருக்கி, அணுவின் மையத்தை நோக்கிச் சுழன்று, பின்னர் அணுக்கருவில் சரிந்துவிடும்.
புதிய யோசனைகள்
El போர் அணு மாதிரி இந்த சிக்கலுக்கு தீர்வை அளித்தது, எலக்ட்ரான்கள் அணுக்கருவைச் சுற்றியுள்ள சுற்றுப்பாதையில் சுற்றுகின்றன, ஆனால் சில அனுமதிக்கப்பட்ட சுற்றுப்பாதைகளில் மட்டுமே மற்றும் பிளாங்கின் மாறிலிக்கு விகிதாசாரமாக இருக்கும் ஒரு குறிப்பிட்ட ஆற்றலுடன்.
இந்த அனுமதிக்கப்பட்ட சுற்றுப்பாதைகளுக்கு ஆற்றல் குண்டுகள் அல்லது ஆற்றல் நிலைகள் என்ற பெயர் வழங்கப்பட்டது. இதன் பொருள் ஒரு அணுவிற்குள் இருக்கும் எலக்ட்ரானின் ஆற்றல் திறன் தொடர்ச்சியாக இல்லை, ஆனால் ஒரு குறிப்பிட்ட அளவில் அளவிடப்படுகிறது.
இந்த நிலைகள் ஒரு குவாண்டம் எண் n (n = 1, 2, 3 மற்றும் பல) உடன் அடையாளம் காணப்படுகின்றன, மேலும் போரின் கூற்றுப்படி, இந்த குவாண்டம் எண்ணை ரைபெர்க் சூத்திரத்தைப் பயன்படுத்தி நிறுவலாம், இது 1888 இல் ஸ்வீடிஷ் இயற்பியலாளர் ஜோஹன்னஸ் ரைபெர்க்கால் உருவாக்கப்பட்டது. பல வேதியியல் தனிமங்களின் நிறமாலைக் கோடுகளின் அலைநீளங்களைக் குறிக்கும்.
எலக்ட்ரான்கள் ஒரு குறிப்பிட்ட சுற்றுப்பாதையில் இருந்து மற்றொன்றுக்குத் தாவ முடிந்தால் மட்டுமே அவற்றின் ஆற்றலை அதிகரிக்கவோ அல்லது குறைக்கவோ முடியும் என்பதை இந்த ஆற்றல் நிலைகள் சுட்டிக்காட்டுகின்றன, மேலும் இது நிகழும்போது, எலக்ட்ரான் செயல்பாட்டில் மின்காந்த கதிர்வீச்சை கதிர்வீச்சு அல்லது உறிஞ்சிவிடும்.
El போர் அணு மாதிரி இது ரதர்ஃபோர்டின் மாதிரியின் மாற்றமாக இருந்தது. அந்த காரணத்திற்காக, வெகுஜனத்தின் பெரும்பகுதியைக் கொண்ட ஒரு சிறிய மையக்கருவின் தனித்தன்மைகள் நீடித்தன. அதே வழியில், எலக்ட்ரான்கள் சூரியனைச் சுற்றியுள்ள கிரகங்களைப் போலவே கருவைச் சுற்றி அவற்றின் சுற்றுப்பாதை இயக்கத்தைச் செய்தன, ஆனால் அவற்றின் சுற்றுப்பாதை இயக்கங்கள் தட்டையாக இல்லை.
போர் அணு மாதிரியின் அடிப்படைக் கோட்பாடுகள்
நேர்மறை அடையாளத்தின் மின் ஆற்றலுடன் கூடிய சார்ஜ் செய்யப்பட்ட துகள்கள், அணுவின் கன அளவுடன் ஒப்பிட்டு, அணுவின் வெகுஜனத்தின் மிகப்பெரிய பகுதியை உள்ளடக்கியிருந்தால், மிகச் சிறிய அளவில் காணப்படுகின்றன. எதிர்மறை மின்னேற்றம் கொண்ட எலக்ட்ரான்கள், ஏற்கனவே முன்னரே தீர்மானிக்கப்பட்ட அளவு மற்றும் ஆற்றலைக் கொண்ட வட்ட சுற்றுப்பாதையில் கருவைச் சுற்றி நகரும் போது. இதன் காரணமாக, அவை சுற்றுப்பாதைகளுக்கு இடையில் ஒரு இடைநிலை நிலையில் இல்லை.
சுற்றுப்பாதையின் ஆற்றல் அதன் அளவிற்கு விகிதாசார உறவைக் கொண்டுள்ளது. மிகச்சிறிய சுற்றளவு கொண்ட சுற்றுப்பாதையில் குறைந்த ஆற்றல் காணப்படுகிறது. அணுக்கருவிலிருந்து ஒரு ஆற்றல் மட்டம் எவ்வளவு தூரம் இருக்கிறதோ, அந்த அளவுக்கு அது கொண்டிருக்கும் ஆற்றலின் அளவு அதிகமாகும்.
வெவ்வேறு ஆற்றல் நிலைகள் வெவ்வேறு எண்ணிக்கையிலான எலக்ட்ரான்களைக் கொண்டுள்ளன. குறைந்த ஆற்றல் நிலை, குறைவான எலக்ட்ரான்களைக் கொண்டுள்ளது. எடுத்துக்காட்டாக, நிலை 1 இல் 2 எலக்ட்ரான்கள் வரை இருக்கும், நிலை 2 இல் 8 எலக்ட்ரான்கள் வரை இருக்கும், மற்றும் பல. எனவே ஒரு எலக்ட்ரான் ஒரு சுற்றுப்பாதையில் இருந்து மற்றொன்றுக்கு மாறும் தருணத்தில் ஆற்றல் கதிர்வீச்சு அல்லது உறிஞ்சப்படுகிறது.
கூடுதல் போர் அணு மாதிரி பரிசீலனைகள்
இருப்பதற்கான காரணம் போர் அணு மாதிரி முந்தைய அணு மாதிரிகள் செய்யாத பொருள் நிலையானதாக உள்ளது, அத்துடன் வாயுக்களின் உறிஞ்சுதல் மற்றும் கதிர்வீச்சு நிறமாலை ஆகியவற்றை விளக்குவது.
குவாண்டிசேஷன் என்ற கருத்தை முதன்முதலில் பயன்படுத்தியவர் போர்ஸ் ஆவார், இது கிளாசிக்கல் மெக்கானிக்ஸ் மாதிரிக்கு இடையில் உள்ளது. பிளேஸ் பாஸ்கலின் பங்களிப்புகள் மற்றும் ஒரு குவாண்டம் இயந்திர மாதிரி. சில ஆண்டுகளுக்கு முன்பு மாக்ஸ் பிளாங்க் செய்த அளவு கண்டுபிடிப்புகளையும் ஆல்பர்ட் ஐன்ஸ்டீனின் கோட்பாடுகளையும் இணைத்து அவர் ரூதர்ஃபோர்டின் மாதிரியை மேம்படுத்தினார்.
அதன் குறைபாடுகள் இருந்தபோதிலும், தி போர் அணு மாதிரி ஷ்ரோடிங்கர் மற்றும் பிற விஞ்ஞானிகளால் தொடங்கப்பட்ட குவாண்டம் இயக்கவியலின் பிறப்புக்கு முன்னோடியாக இருந்தது. பிளாங்கின் குவாண்டம் கோட்பாடு.
போர் மாதிரியில் வரம்புகள் மற்றும் பிழைகள்
எலக்ட்ரான்கள் ஏன் சில சுற்றுப்பாதைகளில் தனித்துவமாக வரையறுக்கப்பட்டுள்ளன என்பதை மாதிரி விளக்கவில்லை.
மாதிரியில் எலக்ட்ரான்கள் அறியப்பட்ட ஆரம் மற்றும் சுற்றுப்பாதையைக் கொண்டிருப்பதாகக் கூறப்பட்டது, அதை வெர்னர் ஹைசன்பெர்க்கின் நிச்சயமற்ற கொள்கை பத்து ஆண்டுகளுக்குப் பிறகு நிரூபிக்கும்.
El போர் அணு மாதிரி ஹைட்ரஜன் அணுக்களில் எலக்ட்ரான்களின் நடத்தையை இனப்பெருக்கம் செய்யும் திறனைக் கொண்டிருந்தது, ஆனால் அதன் வடிவங்கள் அதிக எண்ணிக்கையிலான எலக்ட்ரான்களைக் கொண்ட பிற தனிமங்களின் அணுக்களுக்குப் பொருந்தாது.
ஜீமன் விளைவை விளக்கும்போது இந்த அணு மாதிரி முரண்பாடுகளை முன்வைத்தது. வெளிப்புற மற்றும் அசையாத காந்தப்புலத்தின் முன்னிலையில், நிறமாலை கோடுகள் இரண்டு அல்லது அதற்கு மேற்பட்டதாக பிரிக்கப்படும்போது இந்த விளைவைக் காணலாம்.
அதேபோல், தி போர் அணு மாதிரி தரை நிலையில் உள்ள பொருளின் சுற்றுப்பாதை கோண உந்தத்திற்கு தவறான மதிப்பை அளிக்கிறது.
இந்த காரணங்கள் அனைத்தும் வழிவகுத்தன போர் அணு மாதிரி இது பல ஆண்டுகளுக்குப் பிறகு குவாண்டம் கோட்பாட்டால் மாற்றப்பட்டது, இது ஹைசன்பெர்க் மற்றும் ஷ்ரோடிங்கரின் விஞ்ஞானப் பணியின் விளைவாகும்.
நீல்ஸ் போர் யார்?
நீல்ஸ் போர் டென்மார்க்கின் கோபன்ஹேகன் நகரில் அக்டோபர் 1885 இல் பிறந்த ஒரு இயற்பியலாளர் ஆவார். அவரது தந்தை ஒரு பல்கலைக்கழக பேராசிரியர் மற்றும் அவரது தாயார் ஒரு பணக்கார குடும்பத்தின் மகள். 1903 ஆம் ஆண்டில் இயற்பியல் படிப்பதற்காக கோபன்ஹேகன் பல்கலைக்கழகத்தில் நுழைவதற்கு அவருக்கு வாய்ப்பு கிடைத்தது, ஆனால் அவர் வானியல் மற்றும் கணிதத்தையும் படித்தார். 1911 இல் அவர் தனது மருத்துவர் பட்டத்தைப் பெற முடிந்தது.
1911 ஆம் ஆண்டில், கார்ல்ஸ்பெர்க் அறக்கட்டளையின் உதவித்தொகையைப் பெற்றதற்கு நன்றி, அணுவைப் பற்றிய ஆய்வுக்கு அதன் ஆதாரங்களை அர்ப்பணித்தார், அவர் லண்டனுக்குச் செல்ல முடிந்தது, மேலும் அவர் தங்கியிருந்தபோது ஜேஜே தாம்சன் மற்றும் எர்னஸ்ட் ரூதர்ஃபோர்ட் போன்ற தொடர்புடைய விஞ்ஞானிகளைச் சந்தித்தார்.
1912 ஆம் ஆண்டில், அவர் டென்மார்க்கிற்குத் திரும்பினார், மார்கிரேத் நோர்லூட்டை மணந்தார், அவருக்கு ஆறு குழந்தைகள் இருந்தனர், அவர்களில் ஒருவர் புகழ்பெற்ற இயற்பியலாளர் ஆனார், அவர் 1975 இல் நோபல் பரிசை வென்றார், அவரது தந்தை பல ஆண்டுகளுக்கு முன்பு செய்ததைப் போலவே.
டென்மார்க்கில் நிறுவப்பட்டது மற்றும் அவரது நாட்டில் இயற்பியலின் செல்வாக்கின்மை காரணமாக, அவர் மருத்துவ மாணவர்களுக்கு கற்பிக்க வேண்டிய கட்டாயம் ஏற்பட்டது, இது போரை விரும்பாத உண்மை, பின்னர் இங்கிலாந்தின் மான்செஸ்டருக்குத் திரும்பினார், அங்கு ரதர்ஃபோர்ட் அவருக்கு ஒரு பதவியை வழங்கினார். முதல் உலகப் போர் தொடங்கி 2 ஆண்டுகள் வரை லண்டனில் இருந்தார்.
இயற்பியல் இயக்குனர் மற்றும் நோபல் பரிசு
1916 ஆம் ஆண்டில் அவர் கோபன்ஹேகன் பல்கலைக்கழகத்தில் கோட்பாட்டு இயற்பியல் இயக்குநராக நியமிக்கப்பட்டார், இது அவருக்கு குறிப்பாக உருவாக்கப்பட்டது. 1918 ஆம் ஆண்டில், டேனிஷ் இன்ஸ்டிடியூட் ஃபார் கோட்பாட்டு இயற்பியலை உருவாக்க அவர் அரசாங்கத்தை சமாதானப்படுத்தினார், இது இன்று நீல்ஸ் போர் நிறுவனம் என்று அழைக்கப்படுகிறது, இது 1921 இல் அதன் பயணத்தைத் தொடங்கியது, அவரை அதன் முக்கிய இயக்குநராகக் கொண்டு.
அணுக்கள் மற்றும் அவை வெளியிடும் கதிர்வீச்சு குறித்து ஆய்வு செய்ததற்காக, 1922ல் இயற்பியலுக்கான நோபல் பரிசு அவருக்கு வழங்கப்பட்டது. பின்னர், 1924 ஆம் ஆண்டில், போர் டென்மார்க்கில் ஹைசன்பெர்க்கைச் சந்தித்தார், பின்னர் கோபன்ஹேகனில் குவாண்டம் இயக்கவியலின் சிந்தனை மற்றும் விளக்கத்தை வடிவமைத்த பால் டிராக் மற்றும் எர்வின் ஷ்ரோடிங்கர் போன்ற விஞ்ஞானிகளைப் பெறும் வாய்ப்பைப் பெற்றார்.
போர் நவம்பர் 18, 1962 அன்று டென்மார்க்கின் கார்ல்ஸ்பெர்க்கில் இறந்தார், ஆனால் அவர் தனது நாட்டில் நவீன இயற்பியலின் தந்தை ஆவார்.
இந்த வாசிப்பு அன்று என்று நம்புகிறோம் போர் அணு மாதிரி சுவாரஸ்யமாக இருந்தது மேலும் எங்களின் அறிவியல் உள்ளடக்கத்தைப் பற்றி மேலும் அறிய உங்களை அழைக்கிறோம்.