ગ્રીક ફિલસૂફ ડેમોક્રિટસ દ્વારા રજૂ કરાયેલ અણુની કલ્પના સમગ્ર સદીઓ દરમિયાન ઘણા વૈજ્ઞાનિકો દ્વારા શેર કરવામાં આવી ન હતી. પરંતુ વર્ષ 1804 માં, ધ ડાલ્ટન એટોમિક મોડલ, ગ્રીક પરમાણુવાદીઓના સિદ્ધાંતો પર આધારિત, જે સ્વીકારવામાં આવી હતી.

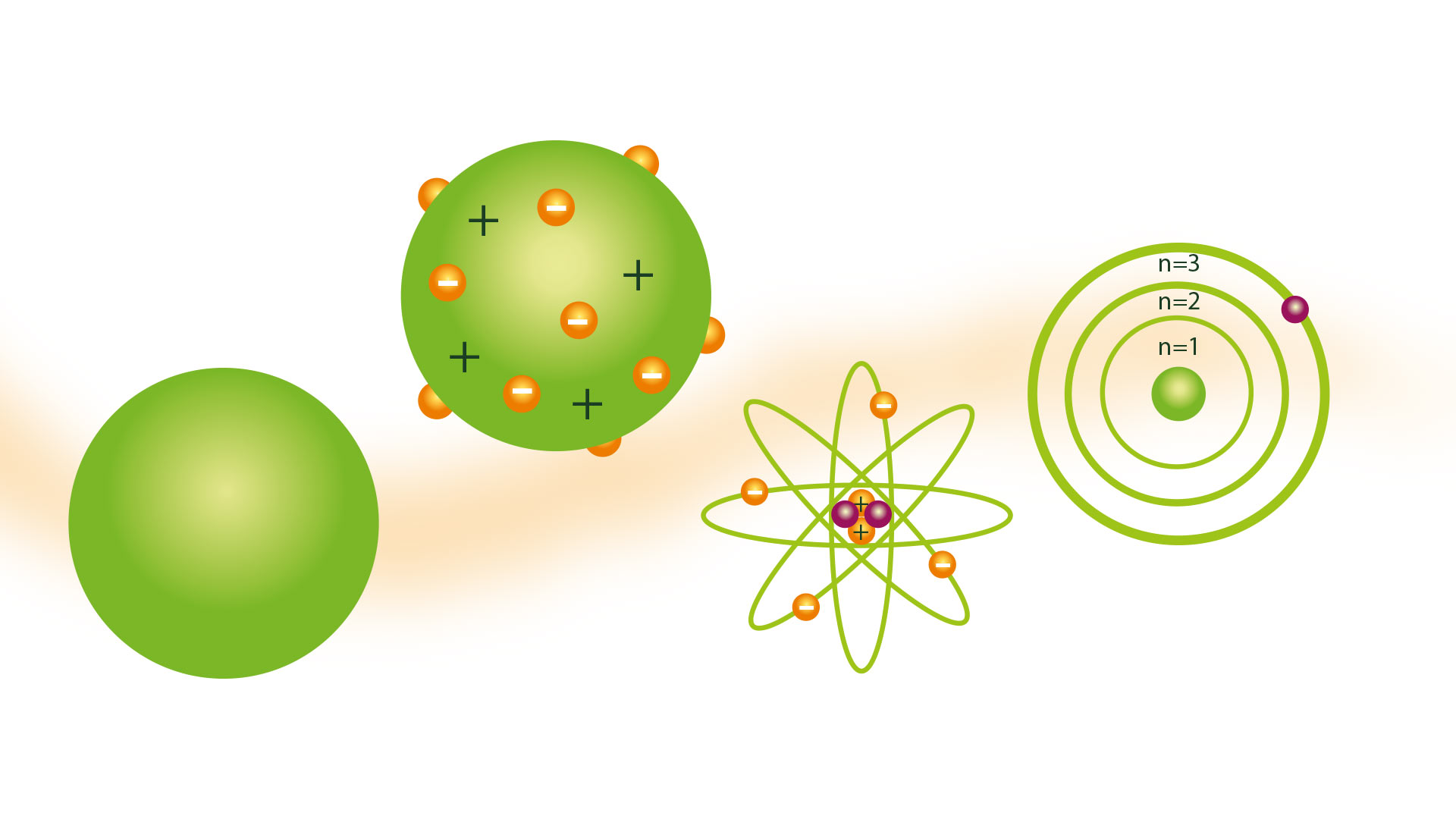
ડાલ્ટનનું અણુ મોડેલ
પરમાણુવાદી વિચાર અને ગ્રીક ફિલોસોફિકલ વિચારો પછી, એક નવો અણુ સિદ્ધાંત વૈજ્ઞાનિક વિશ્વમાં જાણીતો થયો ત્યાં સુધી લગભગ 2 હજાર વર્ષ વીતી ગયા. તેનું મૂળ જ્હોન ડાલ્ટનની તપાસમાં હતું, જેઓ બ્રિટિશ ભૌતિકશાસ્ત્રી, રસાયણશાસ્ત્રી અને હવામાનશાસ્ત્રી હતા અને પ્રથમ આધુનિક અણુ સિદ્ધાંતના પ્રચારક હતા.
એવું કહી શકાય કે ડાલ્ટન એક સંપૂર્ણ વૈજ્ઞાનિક તરીકે ઓળખાતા હતા, કારણ કે તેમનો અભ્યાસ માત્ર ભૌતિકશાસ્ત્ર પૂરતો મર્યાદિત ન હતો, તેનાથી વિપરીત, માનવ આંખ દ્વારા રંગોની પ્રશંસા કરવામાં સક્ષમ બનવાની અશક્યતા પરના તેમના સંશોધન માટે પણ તેઓ વ્યાપકપણે ઓળખાય છે, એક એવી શરત કે જેના કારણે આજે તેને ડાલ્ટોનિઝમ તરીકે ઓળખવામાં આવે છે.
તેમનું અણુ મોડેલ બિલિયર્ડ બોલ મોડલ તરીકે જાણીતું હતું અને તે 1804માં રજૂ કરવામાં આવ્યું હતું. ડાલ્ટન એક વૈજ્ઞાનિક સંશોધક હતા અને તેમનું મોડેલ તે ઉત્પાદન હતું જે તેમણે વાયુઓ સાથે હાથ ધરેલા અનેક પ્રયોગોનું પરિણામ હતું. તે જેવા સિદ્ધાંતોના અગ્રદૂત હતા રધરફોર્ડ એટોમિક મોડલ.
તેના કામના તારણો અને અસરોને આધારે, ડાલ્ટન એ સાબિત કરવામાં સક્ષમ હતા કે ગ્રીકો જે અણુઓ વિશે વાત કરે છે તે ખરેખર અસ્તિત્વમાં છે, એક મુદ્દો જે ડેમોક્રિટસનો અણુ સિદ્ધાંત આધુનિક ભૌતિકશાસ્ત્રના ઈતિહાસમાં અણુના અસ્તિત્વનો પ્રથમ વૈજ્ઞાનિક આધારિત સિદ્ધાંત સ્થાપિત કરવામાં સક્ષમ હોવાને કારણે તેણે માત્ર સ્કેચ જ બનાવ્યું હતું.
ડાલ્ટનના અણુ મોડેલના મૂળભૂત સિદ્ધાંતો
1803 અને 1807 ની વચ્ચે કલ્પના કરાયેલ મિકેનિઝમ, કન્ફોર્મેશન અને પરમાણુના સ્થાન પર ડાલ્ટનનું અણુ મોડેલ પ્રથમ વિઝ્યુલાઇઝ્ડ પ્રયાસ હતો, જ્હોન ડાલ્ટને સૌપ્રથમ તેને અણુ સિદ્ધાંતનું નામ આપ્યું અને તેના આધારે, નીચેનું પરિસર બનાવ્યું:
પ્રથમ ધારણા
તેણે નક્કી કર્યું કે તમામ દ્રવ્ય પ્રાથમિક કણોથી બનેલું છે, જેને અણુ કહેવાય છે અને તેને ન તો વિભાજિત કરી શકાય છે કે ન તો તેનો નાશ કરી શકાય છે. તેઓ રાસાયણિક પ્રતિક્રિયામાં પણ બનાવી અથવા બદલી શકાતા નથી.
બીજી ધારણા
અણુઓ કે જે કોઈપણ તત્વ બનાવે છે તે એકબીજા સાથે સમાન હોય છે, માત્ર વજનમાં જ નહીં, પણ અન્ય લાક્ષણિકતાઓમાં પણ. તેથી, બધા ઓક્સિજન અણુઓ એકદમ સમાન છે. તેના બદલે, વિવિધ તત્વોના અણુઓ તેમના વજન દ્વારા એકબીજાથી અલગ પડે છે. આ ધારણા માટે આભાર, હાઇડ્રોજન સાથે વિવિધ અણુઓની સરખામણી દ્વારા સંબંધિત અણુ વજનનું જ્ઞાન ઉદભવ્યું, જે ડાલ્ટનના મતે સૌથી સરળ હતું.
ત્રીજી ધારણા
અણુઓને વિભાજિત કરી શકાતા નથી, પછી ભલેને તેમના પર કોઈપણ પ્રકારની રાસાયણિક ક્રિયા કરવામાં આવે. સમાન અથવા અલગ અણુઓનું સંયોજન વધુ જટિલ સંયોજનો અથવા પદાર્થોને જન્મ આપશે, પરંતુ હંમેશા અણુથી દ્રવ્યના લઘુત્તમ મૂળભૂત એકમ તરીકે શરૂ થાય છે.
ચોથું અનુમાન
એકબીજા સાથે અણુઓનું સંયોજન, સંયોજનો બનાવવા માટે, હંમેશા એક સંબંધ જાહેર કરશે જે સરળ અને સંપૂર્ણ સંખ્યામાં વ્યક્ત કરી શકાય છે. અપૂર્ણાંકમાં ક્યારેય નહીં, કારણ કે અણુઓને વિભાજિત કરી શકાતા નથી. તે ઓક્સિજન સાથે થાય છે, જે બે સમાન અણુઓ (O2) દ્વારા રચાય છે, અથવા પાણી સાથે, જે બે સમાન અને એક અલગ (H2O) છે.
પાંચમી ધારણા
અવ્યવસ્થિત તત્વોના અણુઓને વિવિધ માત્રામાં જોડીને, અસંખ્ય વિવિધ સંયોજનો બનાવી શકાય છે. આ એકમાત્ર રસ્તો છે જેમાં તે સમજાવી શકાય છે કે, મર્યાદિત સંખ્યામાં અણુઓથી શરૂ કરીને, બ્રહ્માંડમાંના તમામ પદાર્થોનું નિર્માણ કરવામાં આવ્યું છે. આ વિચારનું ઉદાહરણ આપવા માટે, એક કાર્બન અણુ અને બે ઓક્સિજન અણુ એક સંયોજન (CO2) બનાવશે, પરંતુ દરેક તત્વમાંથી માત્ર એક જ અલગ સંયોજન (CO) બનાવશે.
છઠ્ઠી ધારણા
બધા રાસાયણિક સંયોજનો રચાય છે જ્યારે બે કે તેથી વધુ વિવિધ તત્વોના અણુઓ સતત અને સરળ રીતે જોડાય છે. પરંતુ, અનુસાર ડાલ્ટનનો સિદ્ધાંત, સમાન તત્વના અણુઓ શરૂઆતમાં એકબીજા માટે કોઈ આકર્ષણ દર્શાવતા નથી, ફક્ત વિવિધ અણુઓની હાજરીમાં.
ડાલ્ટનના કાયદા
આ ધારણાઓના પરિણામે, નીચેના કાયદાઓ ઘડવામાં આવ્યા હતા:
- તમામ પદાર્થો અણુઓથી બનેલા છે.
- પૃથ્વી પર અને જાણીતા બ્રહ્માંડ બંનેમાં જે કંઈપણ જાણીતું છે તે અણુઓથી બનેલું છે. દરેક તત્વો અણુઓથી બનેલા છે.
- અણુઓ અવિભાજ્ય અને અવિનાશી છે.
- અણુ એ પદાર્થના નાનામાં નાના કણો છે.
- આપેલ તત્વના તમામ અણુઓ સમાન છે.
- ચોક્કસ તત્વમાં, તેના તમામ અણુઓ સમાન સમૂહ અને સમાન લાક્ષણિકતાઓ ધરાવે છે.
- વિવિધ તત્વોના પરમાણુ સમૂહ અને ગુણધર્મોમાં બદલાય છે.
- દરેક તત્વ વિવિધ લાક્ષણિકતાઓ અને દળના અણુઓથી બનેલું છે.
- સંયોજનો બે અથવા વધુ વિવિધ પ્રકારના અણુઓના સંયોજનથી બનેલા છે.
- ચોક્કસ સંયોજનમાં હંમેશા સમાન પ્રકારના અણુઓ સંયુક્ત અને સમાન પ્રમાણમાં હોય છે.
- રાસાયણિક પ્રતિક્રિયા એ અણુઓની પુન: ગોઠવણી છે.
- રાસાયણિક પ્રતિક્રિયાઓ એ અણુઓના વિભાજન, જોડાણ અથવા પુન: ગોઠવણીનું ઉત્પાદન છે. પરંતુ, રાસાયણિક પ્રતિક્રિયાના પરિણામે એક તત્વના પરમાણુ ક્યારેય બીજા તત્વના પરમાણુ બનતા નથી.
ડાલ્ટન એટોમિક મોડલની વધારાની વિચારણાઓ
ઉપર સૂચિબદ્ધ મૂળભૂત સિદ્ધાંતોની રચના સાથે, ડાલ્ટને દરખાસ્ત કરી હતી કે બે તત્વોના અણુઓ કે જે પરમાણુઓ બનાવવા માટે એકબીજા સાથે સંબંધિત છે તે દળના સંરક્ષણના કાયદાનો આદર કરે છે. આનો અર્થ એ છે કે પરમાણુમાં જોવા મળતા અણુઓની સંખ્યા અને પ્રકારો રાસાયણિક પ્રતિક્રિયામાં ઉપયોગમાં લેવાતા તત્વોના અણુઓની સંખ્યા અને પ્રકારો સમાન છે.
આ સિદ્ધાંતનું અન્ય સુસંગત વિધાન બહુવિધ પ્રમાણનો કાયદો હતું, જે મુજબ જ્યારે બે તત્વોના બે અણુ સંયોજિત થાય છે, ત્યારે જોડાણ માત્ર 1:1, 2:1, 2:2 જેવી પૂર્ણ સંખ્યાઓના ગુણોત્તર અનુસાર થઈ શકે છે. , અને તેથી વધુ. જો પાણીને ઉદાહરણ તરીકે લેવામાં આવે, તો તે જોઈ શકાય છે કે H2O ગુણોત્તર 2:1 માં જોડાય છે, જેનો અર્થ છે કે તેમાં બે હાઇડ્રોજન અણુ અને એક ઓક્સિજન છે.
તેથી, તે શક્ય નથી કે આ તત્વોના અલગ પ્રમાણનો ઉપયોગ પાણી ઉત્પન્ન કરવા માટે થઈ શકે. 3 હાઇડ્રોજન અણુ અને બે ઓક્સિજન અણુ (3:2) નો ઉપયોગ કરીને પાણીનું ઉત્પાદન કરવું શક્ય નથી.
ડાલ્ટન "પરમાણુ વજનનું કોષ્ટક" પણ બનાવવામાં સક્ષમ હતા અને તે કોષ્ટકમાંથી ડેટાનો ઉપયોગ કરીને, તે તત્વોને તેમના તત્વોના વજન દ્વારા નિર્ધારિત ગોઠવણમાં મૂકવા સક્ષમ હતા, હાઇડ્રોજન સાથે સરખામણી કરીને, જે સૌથી હળવા તત્વ છે. , જે તમારા કોષ્ટકમાં પ્રથમ છે અને તેનો અણુ નંબર 1 છે.
બિલિયર્ડ બોલ મોડેલ
અણુઓ એ પદાર્થના નાનામાં નાના કણો છે એવો વિચાર રાખવાનું પરિણામ એ હતું કે તેમને નક્કર અને સખત ગોળાઓ તરીકે કલ્પી શકાય છે, જેના માટે તેમની ઘણી રજૂઆતો લાકડાના ગોળા સાથે બનેલા મોડેલો સાથે કરવામાં આવી હતી, જેના કારણે તેમને બિલિયર્ડ બોલ મળ્યો હતો. મોડલ નામ.
ડાલ્ટનના સિદ્ધાંતની તર્કની સાંકળ વૈજ્ઞાનિક રીતે સંતોષકારક રીતે બે કાયદાઓને સમજાવવામાં સક્ષમ હતી: અચળ પ્રમાણનો કાયદો, જે મુજબ પ્રતિક્રિયા આપતા પદાર્થો વચ્ચે પ્રમાણસરતા નક્કી કરવામાં આવે છે, અને બહુવિધ પ્રમાણનો કાયદો, જે મુજબ પ્રતિક્રિયા આપતા પદાર્થો વચ્ચેના પ્રમાણ હંમેશા સંપૂર્ણ સંખ્યામાં કરશે.
આ રચના દ્વારા ઘટક કણોના મર્યાદિત સમૂહથી શરૂ કરીને અસંખ્ય પ્રાથમિક પદાર્થોના અસ્તિત્વને સમજાવવું પણ શક્ય હતું. તે પછીથી રધરફોર્ડના સિદ્ધાંત અને બોહર અણુ મોડેલ
ડાલ્ટનનું અણુ મોડેલ એ આવશ્યકપણે સરળ સંયોજન મોડેલ છે, જે તેના સમયના લગભગ તમામ રસાયણશાસ્ત્રને સ્પષ્ટીકરણ આપી શકે છે અને તેની સાથે રસાયણશાસ્ત્રના ક્ષેત્રમાં અને વિજ્ઞાનના અન્ય વિવિધ ક્ષેત્રોમાં વિકાસ અને ભાવિ નવીનતાઓ માટેનો પાયો છે.
ડાલ્ટનના પ્રયોગો
પરમાણુવાદીઓથી વિપરીત, જેમણે ફક્ત અણુની કલ્પના કરવા માટે તેમના તર્કનો ઉપયોગ કર્યો હતો, ડાલ્ટને તેમના વિધાનોને અણુના અસ્તિત્વને સાબિત કરતા મોટી સંખ્યામાં પ્રયોગો પર આધારિત હતા, જે સંપૂર્ણપણે રસાયણશાસ્ત્રના પરિપ્રેક્ષ્યમાં હાથ ધરવામાં આવ્યા હતા. કેટલાક શ્રેષ્ઠ જાણીતા હતા:
તેમણે વાયુયુક્ત અવસ્થામાં દ્રવ્ય સાથે પ્રયોગો હાથ ધર્યા, તે દ્રવ્યની સ્થિતિના દબાણની અસરોનું અવલોકન કરીને, એવા નિષ્કર્ષ પર પહોંચ્યા કે જે અણુઓમાંથી વાયુયુક્ત પદાર્થો બનેલા છે તે અવિરત આકસ્મિક હિલચાલમાં છે.
તેમના કેટલાક પ્રયોગો સંયોજનોના પરમાણુઓ બનાવવા માટે તત્વોના મિશ્રણ પર આધારિત હતા, જેના પરિણામોએ તેમને ખાતરી આપી હતી કે આપેલ સંયોજન હંમેશા સમાન પ્રમાણમાં સમાન તત્વોથી બનેલું રહેશે અને તેમના બહુવિધ પ્રમાણના કાયદાનું પાલન કરશે.
ડાલ્ટન એટોમિક મોડલની સ્વીકૃતિ
ડાલ્ટનના અણુ સિદ્ધાંતને તેના સમયના ઘણા વૈજ્ઞાનિકો દ્વારા વ્યાપકપણે સ્વીકારવામાં આવ્યો હતો અને તેના માટે વધુ સમયની જરૂર ન હતી અને તે આજના અણુ સિદ્ધાંતના કેટલાક વિભાગોનો આધાર બની ગયો હતો.
જો કે આજે વૈજ્ઞાનિકો પણ જાણે છે કે અણુ એ પદાર્થના સૌથી નાના કણો નથી, કારણ કે, જેમ જાણીતું છે, અણુઓમાં પ્રોટોન, ન્યુટ્રોન અને ઇલેક્ટ્રોન જેવા અનેક પ્રકારના નાના કણો હોય છે. ડાલ્ટનનો સિદ્ધાંત તરત જ રસાયણશાસ્ત્રના સૈદ્ધાંતિક આધાર તરીકે સ્થાપિત થયો.
ડાલ્ટનની થિયરીમાં મર્યાદાઓ અને ભૂલો
ડાલ્ટનની ધારણા હતી કે તમામ તત્વોના પરમાણુ વ્યક્તિગત રહે છે, જેના કારણે તે સમજી શક્યા ન હતા કે કેટલાક તત્વોમાં અણુઓ પરમાણુઓમાં અસ્તિત્વ ધરાવે છે, જેમ કે શુદ્ધ ઓક્સિજનના કિસ્સામાં જે O2 તરીકે અસ્તિત્વ ધરાવે છે, એટલે કે, બે ઓક્સિજન અણુઓ સાથે સમાન તત્વનો પરમાણુ.
તેવી જ રીતે, બે તત્વો વચ્ચેનું સૌથી સરળ સંયોજન એ દરેકનો એક અણુ સતત હોય છે તેવો તેમનો વિચાર ખોટો હતો. ભૂલ જે તેને અનુમાન કરવા તરફ દોરી ગઈ કે પાણી માટેની અભિવ્યક્તિ H2O ને બદલે HO હતી.
હકીકત એ છે કે તેણે તેના પ્રયોગો કરવા માટે જે સાધનસામગ્રીનો ઉપયોગ કર્યો તે ખૂબ જ મૂળભૂત હતું તે ડાલ્ટનને ઘણા ખોટા તારણો તરફ દોરી ગયું. તેની શરૂઆતમાં તેણે ઓક્સિજનને 5.5 નું મૂલ્ય આપ્યું, જેનો અર્થ છે કે તે હાઇડ્રોજન અણુ કરતાં 5.5 ગણો વધુ પ્રચંડ હતો, જેનો ઉપયોગ તેણે તેના સંદર્ભ તરીકે કર્યો હતો. જો કે, તેના સમયના અન્ય સંશોધકોએ ઓક્સિજનને 7 નું મૂલ્ય આપ્યું હોવા છતાં, તે વર્ષો પછી તે મૂલ્યોને સુધારી શક્યા, ઓક્સિજનને 8 નું મૂલ્ય આપ્યું.
ડાલ્ટનની થિયરીની અસર
એ સાચું છે કે વર્તમાન અણુ સિદ્ધાંત એવા સ્તરે પહોંચી ગયો છે જે થોડા વર્ષો પહેલા અવર્ણનીય હતા, પરંતુ ડાલ્ટનની પ્રતિભા એ છે કે તેના સિદ્ધાંતના આવશ્યક સિદ્ધાંતો હજુ પણ અમુક બાબતોમાં માન્ય છે. જો કે, આજે તે જાણીતું છે કે પરમાણુ સ્તરે પ્રતિક્રિયાઓ દ્વારા અણુઓને અલગ કરી શકાય છે, પરંતુ તેનો અર્થ એ નથી કે ડાલ્ટનનું નિવેદન કે તેઓ રાસાયણિક પ્રતિક્રિયાઓના માધ્યમથી અલગ થઈ શકતા નથી તે હવે માન્ય નથી.
વધુમાં, આજે એ પણ જાણીતું છે કે એક જ તત્વના તમામ અણુઓ સમાન દળ ધરાવતા નથી, કારણ કે તે દર્શાવવું શક્ય બન્યું છે કે આઇસોટોપ્સ અસ્તિત્વમાં છે, જે વધારાના ન્યુટ્રોન સાથેના અણુઓ છે અને જ્યારે તે હોય ત્યારે પણ તેઓનો સમૂહ વધારે હોય છે. સમાન. તત્વ.
ડાલ્ટનની બાયોગ્રાફી
જ્હોન ડાલ્ટનનો જન્મ 6 સપ્ટેમ્બર, 1766ના રોજ ઈંગ્લેન્ડમાં થયો હતો, તેમનું કુટુંબ નમ્ર હતું અને તેમનું પ્રારંભિક શિક્ષણ તેમના માતા-પિતા અને તેમના નગરની શાળામાંથી થયું હતું. તેમના મૂળ અને તેમના પરિવારની આર્થિક સ્થિતિને લીધે, તેમણે 10 વર્ષની ઉંમરે કામ કરવાનું શરૂ કરવું પડ્યું, એક ઘરમાં સેવા આપી, જોકે એવું પણ કહેવાય છે કે તેમણે 12 વર્ષની ઉંમરે એક શાળામાં ભણાવવાનું શરૂ કર્યું હતું અને તે 14 વર્ષની ઉંમરે બની ગયો હતો. લેટિનમાં નિપુણ.
ડાલ્ટને તે જે વિસ્તારમાં રહેતા હતા ત્યાંના પ્રશિક્ષકો પાસેથી અનૌપચારિક સૂચનાઓ શીખવવાનું અને પ્રાપ્ત કરવાનું ચાલુ રાખ્યું, અને જ્યારે તે 27 વર્ષની ઉંમરે પહોંચ્યો ત્યારે તેને માન્ચેસ્ટરની એક નાની યુનિવર્સિટીમાં ગણિત અને પ્રાકૃતિક ફિલસૂફીના પ્રોફેસર તરીકે નિમણૂક મળી, આ પદ પર તે ચાલુ રહ્યો. ઘણા વર્ષો સુધી. 7 વર્ષ, જ્યાં સુધી હું તે જ વિષયો માટે ખાનગી શિક્ષક બનવાનો નિર્ણય ન લઉં ત્યાં સુધી.
વૈજ્ઞાનિક યોગદાન
નિઃશંકપણે, તેમના સૌથી સુસંગત યોગદાનમાં તેમનો અણુનો સિદ્ધાંત છે, પરંતુ જ્હોન ડાલ્ટને આના પર અભ્યાસ અને પ્રયોગો કર્યા:
- હવામાનશાસ્ત્ર.
- પર્વતોની ઊંચાઈનું માપ.
- રંગ અંધત્વ, એક એવી સ્થિતિ કે જેને પાછળથી તેમના માનમાં ડાલ્ટોનિઝમ નામ આપવામાં આવ્યું.
- ગેસ સંબંધિત કેટલાક કાયદા.
અને તેમણે નાના વિષયો પર તેમની કૃતિઓના અન્ય ઘણા પ્રકાશનો કર્યા, જેમ કે આકાશના રંગ અને અંગ્રેજી વ્યાકરણ પર પણ.
ડાલ્ટન આરક્ષિત પાત્રનો માણસ હતો અને તેણે ક્યારેય લગ્ન કર્યા ન હતા. પોતાની જાતને ફક્ત તેમના સંશોધન માટે સમર્પિત કરીને, તેમણે ખૂબ જ હલફલ વિના સાધારણ જીવન જીવ્યું. 1837 અને 1838ના વર્ષોમાં તેને હુમલાનો ભોગ બન્યો જેના પરિણામે તે મૂંગો બની ગયો, પરંતુ તે 1844માં તેના મૃત્યુના વર્ષ સુધી, તપાસ કરવાનું ચાલુ રાખતો ન હતો.