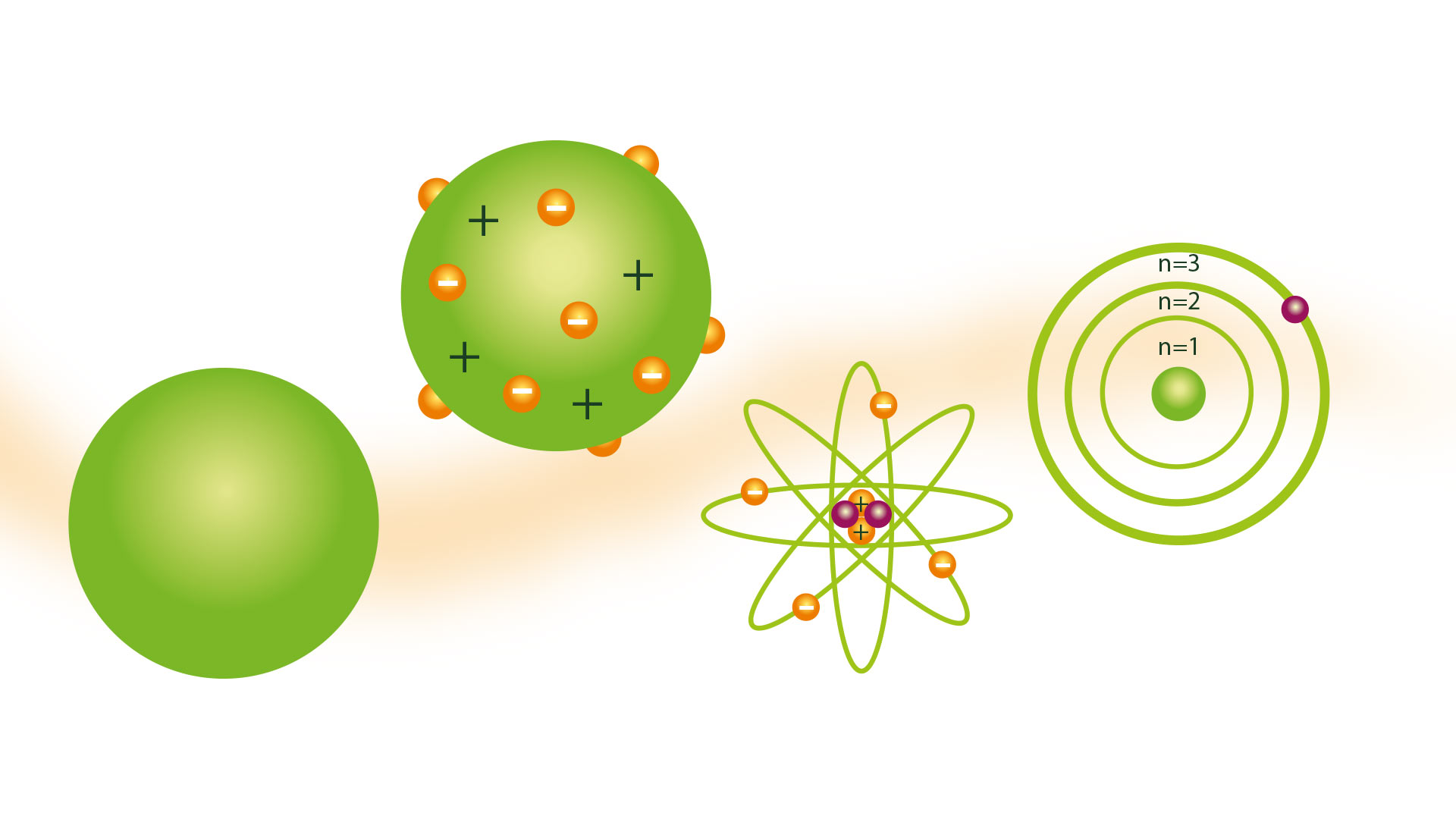
Fikradda atamka sida uu soo bandhigay faylasuufkii Giriigga ee Democritus ma aysan wadaagin saynisyahano badan qarniyadii oo dhan. Laakiin sannadku markuu ahaa 1804 kii Dalton Atomic Model, oo ku salaysan aragtiyaha Atomists-ka Giriigga, oo la aqbalay.

Qaabka Atoomiga ee Dalton
Kadib fikirkii atomiga iyo fikradaha falsafada Giriigga, qiyaastii 2 kun oo sano ayaa ka soo wareegtay ilaa aragti cusub oo atomiga la ogaaday adduunka sayniska. Asalkeedu waxa uu ahaa baadhitaanadii John Dalton, oo ahaa physicist Ingiriis ah, farmashiistaha iyo saadaasha hawada waxana uu ahaa dhiirrigeliye aragtidii ugu horreysay ee atomiga casriga ah.
Waxa la odhan karaa Dalton waxa uu ahaa waxa loogu yeedho saynisyahan dhamaystiran, sababtoo ah waxbarashadiisu kuma koobnayn Fiisigiska, taa caksigeeda, waxa kale oo uu si weyn loogu aqoonsaday cilmi-baadhistiisa in aanay suurtogal ahayn in la qiimeeyo midabada isha bini’aadamka. Shuruud isaga mahadii, maanta loo yaqaan Daltonism.
Qaabka atomiga waxa loo yiqiin qaabka kubbadda billiardka waxana la soo bandhigay 1804tii. Dalton waxa uu ahaa cilmi baadhe cilmiyaysan, moodelkiisuna waxa uu ahaa sheyga uu gaadhay ka dib go'aanadii ka soo baxay tijaabooyin badan oo uu sameeyay. Wuxuu ahaa hormoodka aragtiyaha ay ka mid yihiin Rutherford Atomic Model.
Isagoo gundhig ka dhiganaya gunaanadka iyo saamaynta shaqadiisa, Dalton waxa uu awooday in uu caddeeyo in atamka ay Giriiggu ka hadleen ay dhab ahaan jireen, arrinkaas Aragtida Atoomiga ee Democritus Waxa uu sameeyay oo kaliya, isaga oo awood u leh in uu aasaaso aragtidii ugu horreysay ee cilmi ahaan ku salaysan jiritaanka atamka ee taariikhda fiisigiska casriga ah.
Mabaadi'da aasaasiga ah ee Qaabka atomiga ee Dalton
Qaabka atomiga ee Dalton wuxuu ahaa isku daygii ugu horreeyay ee la arki karo ee habka, qaabaynta iyo goobta atamka, oo la raray intii u dhaxaysay 1803 iyo 1807, John Dalton wuxuu markii hore u bixiyay magaca aragtida atomiga oo ku salaysan, wuxuu sameeyay dhismooyinka soo socda:
marka hore postulate
Waxa uu go'aamiyay in wax walba ay ka kooban yihiin qaybo hoose, oo loo yaqaan atom, oo aan la qaybin karin lana burburin karin. Sidoo kale laguma abuuri karin ama laguma beddeli karin fal-celin kiimikaad.
postulate labaad
Atamyada ka kooban curiye kasta waa isku mid, maaha miisaanka oo kaliya, laakiin sidoo kale sifooyinka kale. Sidaa darteed, dhammaan atamka ogsijiinta gabi ahaanba waa siman yihiin. Taa beddelkeeda, atamka curiyeyaasha kala duwan ayaa midba midka kale kaga duwan yahay miisaankooda. Thanks to this postulate, aqoonta miisaanka atamka qaraabo kacay, iyada oo la barbardhigo atamka kala duwan iyo kan hydrogen, taas oo sida uu Dalton ahaa ugu fudud.
postulate saddexaad
Atomyada lama qaybin karo, iyadoon loo eegayn nooca ficilka kiimikaad ee lagu sameeyo iyaga. Isku dhafka atomyada isku midka ah ama kuwa kala duwan ayaa soo saari doona isku-dhafan ama walxo aad u adag, laakiin had iyo jeer laga bilaabo atamka oo ah qaybta aasaasiga ah ee ugu yar.
postulate afraad
Isku-dhafka atomyada midba midka kale, si loo sameeyo isku-dhafka, ayaa had iyo jeer muujin doona xiriir lagu muujin karo tirooyin fudud oo dhammaystiran. Waligaa ha noqonin jajab, maadaama atamka aan la qaybin karin. Taasi waa waxa ku dhaca ogsijiinta, oo ay ku abuurmaan laba atomi oo siman (O2), ama biyo, kuwaas oo ah laba siman iyo mid kala duwan (H2O).
postulate shanaad
Marka la isku daro atomyada curiyeyaasha random ee xaddi kala duwan, tiro badan oo kala duwan ayaa la samayn karaa. Tani waa habka kaliya ee lagu sharxi karo, laga bilaabo tiro xaddidan oo atom ah, dhammaan arrimaha caalamka ayaa la dhisay. Si loo tusaale qaato fikradan, atamka kaarboonka iyo laba atamka oksijiinta ayaa samayn doona iskudhis (CO2), laakiin hal kaliya oo ka mid ah curiye kasta ayaa samayn doona iskudhis kala duwan (CO).
postulate lixaad
Dhammaan iskudhisyada kiimikaad waxay abuurmaan marka atamka laba ama in ka badan oo kala duwan la isku daro, si joogto ah oo fudud. Laakiin, sida laga soo xigtay Aragtida Dalton, atomyada isku element ah marka hore ma muujiyaan wax xidhiidh ah oo midba midka kale, kaliya marka ay joogaan atamka kala duwan.
Sharciyada Dalton
Natiijada qoraalladan, sharciyada soo socda ayaa la sameeyay:
- Dhammaan arrintu waxay ka kooban tahay atamka.
- Dhab ahaantii wax kasta oo la yaqaan waxay ka kooban yihiin atamka, labadaba dhulka iyo koonka la yaqaan. Mid kasta oo ka mid ah curiyayaasha waxay ka samaysan yihiin atamka.
- Atomyadu waa kuwo aan la qaybin oo aan la dumin karin.
- Atomyadu waa qaybaha ugu yar ee maaddada.
- Dhammaan atamka curiyaha la bixiyay waa isku mid.
- Curiye gaar ah, dhammaan atomyadiisa waxay leeyihiin cuf iyo astaamo isku mid ah.
- Atomyada curiyeyaasha kala duwan waxay ku kala duwan yihiin cufnaanta iyo hantida.
- Curiye kastaa waxa uu ka kooban yahay atamka sifooyin iyo cuf kala duwan leh.
- Isku-dhafyadu waxay ka kooban yihiin laba nooc ama ka badan oo kala duwan oo atamka ah.
- Iskudhis gaar ah ayaa had iyo jeer leh isku nooc oo atamka oo la isku daray oo isku saami ah.
- Falcelinta kiimikaad waa dib u habeynta atamka.
- Falcelinta kiimikaad waa wax-soo-saarka kala-tagga, midowga ama dib-u-habaynta atamka. Laakin, atamka hal curiye weligood ma noqdaan atamka curiye kale taasoo ka dhalatay fal-celin kiimikaad.
Tixgelinta Dheeraadka ah ee Qaabka Atoomiga Dalton
Iyadoo ay weheliso abuurista mabaadi'da aasaasiga ah ee kor ku xusan, Dalton wuxuu soo jeediyay in atomiyada laba walxood oo isku xiran si ay u sameeyaan molecules ixtiraamo Sharciga Ilaalinta Mass. Tani waxay ka dhigan tahay in tirada iyo noocyada atamka laga helay molecule ay la mid yihiin tirada iyo noocyada atamka walxaha loo isticmaalo falcelinta kiimikada.
Odhaah kale oo la xidhiidha aragtidani waxa ay ahayd sharciga saami qaybsiga, sida uu qabo marka laba atomi oo laba walxood ah la isku xidho, isku xidhku waxa uu ku iman karaa oo kaliya marka loo eego saamiga tirada guud sida 1:1, 2:1, 2:2 , iyo wixi la mida. Haddii biyaha tusaale loo soo qaato, waxaa la arki karaa in H2O ay isku darsameen saamiga 2:1, taas oo macnaheedu yahay inay leeyihiin laba atom oo hydrogen ah iyo hal oxygen.
Sidaa darteed, suurtogal maaha in qayb kale oo ka mid ah walxahaas loo isticmaalo si loo soo saaro biyaha. Suurtagal maaha in biyo la soo saaro iyadoo la isticmaalayo 3 atamka hydrogen iyo laba atamka oksijiinta (3:2).
Dalton waxa kale oo uu awooday in uu sameeyo “Table of Atomic Weights” isaga oo isticmaalaya xogta miiskaas ka soo baxday, waxa uu awood u yeeshay in uu curiyayaasha ku dhejiyo habayn lagu go’aamiyey miisaanka curiyayaasha ay ku jiraan, marka la barbardhigo hydrogen, oo ah curiyaha ugu fudud. , kaas oo ah kan ugu horreeya miiskaaga oo leh lambarka atomiga ee 1.
Qaabka kubbadda billiardka
Natiijadu waxay tahay in fikradda ah in atomyadu ay yihiin qaybaha ugu yar ee maaddadu waxay ahayd in la qiyaaso inay yihiin goobo adag oo adag, kuwaas oo qaar badan oo ka mid ah matalaadiisa lagu sameeyay moodooyin lagu sameeyay goobo alwaax ah, taas oo uu ugu mahadcelinayo uu helay kubbadda billiardka. magaca model.
Silsiladda sababaynta aragtida Dalton waxa ay awood u yeelatay in ay si cilmiyeysan u qanacdo laba xeer oo kala ah: Xeerka saami qaybsiga joogtada ah, sida uu qabo saami qaybsiga walxaha falcelinta ah, iyo Xeerka saami-qaybsiga, marka loo eego saamiga u dhexeeya falcelinta walxaha. Had iyo jeer waxay sidaas ku samayn doonaan tiro dhan.
Qaabayntan waxa kale oo suurtogal ahayd in lagu sharaxo jiritaanka walxo badan oo hoose, laga bilaabo qaybo kooban oo ka kooban qaybo ka kooban. Markii dambe waxaa lagu hagaajiyay aragtida Rutherford iyo Qaabka Atomiga Bohr
Qaabka atomiga ee Dalton waa nooc asal fudud oo isku-dhafan, kaas oo bixin kara qeexitaan ku dhawaad dhammaan kimistariga waqtigiisa iyo aasaaska horumarka iyo hal-abuurka mustaqbalka ee maadada kimisteriga iyo qaybaha kale duwan ee sayniska.
Tijaabada Dalton
Si ka soo horjeeda Atomists-ka, kuwaas oo kaliya u adeegsaday caqligooda si ay u fahmaan atomka, Dalton wuxuu ku saleeyay sheegashadiisa tiro badan oo tijaabo ah oo caddeeyey jiritaanka atamka, oo laga sameeyay gebi ahaanba dhinaca kimisteriga. Qaar ka mid ah kuwa ugu caansan waxay ahaayeen:
Waxa uu tijaabiyay maadada xaalad gaas ah, isaga oo u kuurgalayay saamaynta cadaadiska xaaladaas maaddadu leedahay, isaga oo gaadhay gunaanadka in atomyada ay ka kooban yihiin arrimaha gaaska ay ku jiraan dhaqdhaqaaq nasiib leh oo aan kala go’ lahayn.
Tijaabadii uu sameeyay qaarkood waxa ay ku saleeyeen walxo isku dhaf ah si uu u sameeyo unugyo isku dhis ah, natiijadii ka soo baxdayna waxa ay u saamaxday in uu caddeeyo in xarun la siiyay ay mar walba ka koobnaan doonto waxyaabo isku mid ah oo isku mid ah isla markaana raacaya sharcigiisa saami qaybsiga badan.
Ogolaanshaha Qaabka Atoomiga Dalton
Aragtida atomiga ee Dalton waxa ay si weyn u aqbaleen saynis yahano badan oo waqtigiisa joogay iyada oo aan wakhti badan loo baahnayn waxa ay saldhig u noqotay qaybo ka mid ah aragtida atomiga maanta.
In kasta oo maanta saynisyahannadu sidoo kale og yihiin in atamka aanay ahayn qaybaha ugu yar ee maaddada, maadaama, sida la og yahay, atamka ka kooban dhawr nooc oo qaybo yaryar ah, sida borotoonnada, neutrons iyo elektaroonnada. Aragtida Dalton ayaa isla markiiba la aasaasay inay noqoto aasaaska aragtida kimistariga.
Xaddidyada iyo Khaladaadka ku jira Aragtida Dalton
Dalton waxa uu lahaa mala-awaal ah in atomyada dhammaan curiyeyaasha ay yihiin kuwo shaqsi ah, taas oo ay ugu wacan tahay ma uu awoodin in uu ogaado in curiyayaasha qaar ay ku jiraan molecules, sida kiiska ogsijiinta saafiga ah ee u jirta sida O2, taas oo ah. molecule ka mid ah curiye isku mid ah oo leh laba atamka oksijiinta.
Sidoo kale, fikraddiisa ah in isku dhafka ugu fudud ee u dhexeeya laba walxood uu yahay mid joogto ah hal atom oo kasta ayaa khaldan. Khalad u horseeday inuu soo saaro in odhaahda biyuhu ay tahay HO halkii ay ka ahayd H2O.
Xaqiiqda ah in qalabkii uu ku samayn jiray tijaabadiisa uu ahaa mid aasaasi ah ayaa Dalton u horseeday gabagabo dhowr ah oo khaldan. Bilawgiisii waxa uu siiyay Ogsajiinta 5.5, taas oo ka dhigan in 5.5 jeer ay ka mug weyn tahay atamka hydrogen-ka, kaas oo ahaa kii uu tixraac ahaan u isticmaalay. Si kastaba ha ahaatee, wuxuu awooday inuu saxo qiyamkaas sanado ka dib, isagoo siinaya oksijiinta qiimaha 7, inkastoo xaqiiqda ah in cilmi-baarayaasha kale ee waqtigiisa ay siiyeen oksijiin qiimo ah 8.
Saamaynta Aragtida Dalton
Waa run in aragtida atomiga ee hadda jirta ay gaartay heerar aan la sifeyn karin dhowr sano ka hor, laakiin garaadka Dalton ayaa ah in mabaadi'da muhiimka ah ee aragtidiisa ay wali ku jiraan dhinacyo gaar ah. Si kastaba ha ahaatee, maanta waxaa la og yahay in atamka lagu kala saari karo falcelinta heerka nukliyeerka, laakiin tani macnaheedu maaha in hadalka Dalton ee ah in aan lagu kala saari karin falcelinta kiimikaad uusan hadda shaqeyn.
Intaa waxaa dheer, maanta waxaa sidoo kale la og yahay in dhammaan atomyada isku midka ah aysan isku mid ahayn, maadaama ay suurtagal tahay in la muujiyo in isotopes ay jiraan, kuwaas oo ah atomyo leh neutrons dheeraad ah, iyo inay leeyihiin miisaan weyn xitaa marka ay tahay isku mid ah. element.
Taariikh Nololeedkii Dalton
John Dalton waxa uu ku dhashay Ingriiska Sebtembar 6, 1766, qoyskiisu waxa ay ahaayeen kuwa is-hoosaysiiya, waxbarashadiisii horena waxa ay ka timid waalidkii iyo dugsi ku yaalla magaaladiisa. Asalkiisa iyo xaaladda dhaqaale ee qoyskiisa awgeed, waxa uu ku qasbanaaday in uu shaqada bilaabo isaga oo 10 jir ah, isaga oo ka shaqaynayey guri, inkasta oo sidoo kale la sheegay in uu dugsi ka bilaabay isaga oo 12 jir ah, isaga oo 14 jir ahna uu noqday. aad u yaqaana Laatiinka.
Dalton waxa uu sii waday in uu wax baro oo uu tusmooyin aan rasmi ahayn ka helo macalimiin ka soo jeeda deegaanka uu ku nool yahay, markii uu gaadhay 27 jir waxa uu helay ballan ah borofisar xisaabta iyo falsafada dabiiciga ah ee jaamacad yar oo ku taal Manchester, jagadaas oo uu sii waday. dhowr sano 7 sano, ilaa aan ka gaaro go'aanka ah inaan noqdo macalin gaar ah oo isla maaddooyinkaas ah.
Wax ku biirinta Sayniska
Shaki la'aan, wax-qabadkiisa ugu muhiimsan waxaa ka mid ah aragtidiisa Atom, laakiin John Dalton wuxuu sameeyay daraasado iyo tijaabooyin:
- Saadaasha hawada.
- Cabbirrada dhererka buuraha.
- Indho-la'aanta midabka, xaalad markii dambe loo bixiyay Daltonism sharaftiisa.
- Qaar ka mid ah Sharciyada la xiriira Gaasaska.
Waxana uu sameeyay daabacado kale oo badan oo uu ka sameeyay maaddooyin yaryar, sida kuwa la xidhiidha midabka cirka iyo xataa naxwaha Ingiriisiga.
Dalton waxa uu ahaa nin dhawrsan oo aan weligii guursan. Isaga oo si gaar ah ugu heellan cilmi-baadhistiisa, waxa uu ku noolaa nolol hufan oo aan buuq badan lahayn. Sanadihii 1837 iyo 1838 waxa uu la kulmay qallal taasoo keentay in uu carrab la'aan noqdo, laakiin taasi kama hor istaagin inuu sii wado baaritaanka, ilaa sanadka dhimashadiisa, 1844-kii.