Lielisks stāsts par to, kā Dmitrijs Ivanovičs Mendeļejevs publicēja pirmo tabulas versiju, kurā ir izskaidrots viss esošais.
Katru gadu miljoniem vidusskolēnu visā pasaulē nonāk pie krāsaina galda, kas ir pilns ar burtiem un cipariem, kas kaut kādā veidā stāsta par visu Visumu. Šī liecība par to, kas mēs esam un no kā viss sastāv, ir elementu periodiskā tabula, kurai 2019. gadā apritēja 150 gadi.
Tas bija krievu ķīmiķis Dmitrijs Ivanovičs Mendeļejevs kurš atrada veidu, kā tabulā sakārtot skābekli, oglekli, dzelzi un visus citus atklātos un vēl jāatklāj elementus, lai tos klasificētu. Viņa ieskats pirmo reizi tika publiskots 6. gada 1869. martā, taču periodiskās tabulas vēsture aizsākās daudz agrāk, un tas daudz pasaka par to, kā darbojas zinātniskā izpēte — veids, kā mēs cenšamies izprast pasauli.
Lavoisier saraksts
Lielākā daļa zinātnes vēsturnieku periodiskās tabulas izcelsmi meklē pētījumos, ko XNUMX. gadsimta beigās veica franču ķīmiķis Antuāns-Lorāns de Lavuazjē. Pirms ļoti slikta beigas, ko Francijas revolucionārā tiesa piesprieda nāvei, nogriežot galvu, Lavuazjē bija atbildīgs par dažiem sava laika svarīgākajiem sasniegumiem zinātniskajā pētniecībā. Kopā ar sievu Mariju Annu viņš daudzus gadus veltīja elementu izpētei.: Vielas, piemēram, skābeklis un ogleklis, ko nevar "sadalīt" ķīmiskās reakcijas rezultātā citās vielās. Lavuazjē arī izteica pirmo masas nezūdamības likuma versiju, sapratis, ka ķīmiskajā reakcijā sākotnējo vielu svaru summai jābūt vienādai ar pēc reakcijas iegūto vielu svaru.
Jo 1789 Lavuazjē publicēja sākotnējo sarakstu no 33 elementiem identificēts līdz tam laikam, zinot, ka, iespējams, ir vēl daudz atklājamo (viņa sarakstā bija aptuveni piektā daļa no mūsdienās zināmajiem). Zelts, dzelzs un sērs ir zināmi kopš seniem laikiem, bet citi ir atklāti nesen. Lai arī saraksts bija nepilnīgs, tas bija pirmais mēģinājums sakārtot elementus, ļoti sarežģīta mīkla, kuras atrisināšana prasīs vairāk nekā gadsimtu un vēl daudzas desmitgades, lai pabeigtu gandrīz visas tās daļas.

Prusts un Daltons
Piecus gadus pēc saraksta publicēšanas tautas revolucionārā tiesa Lavuazjē piesprieda nāvessodu un viņam nocirta galvu. Tas bija 1794. gads, tajā pašā gadā, kad cits zinātnieks, Luiss Džozefs Prusts, viņš bija nonācis pie secinājuma, ka, ja Lavuazjē saglabāšanas likums ir spēkā, tad jāpievieno jauns gabals, kas saistīts ar "noteiktām proporcijām". Prusts savu jauno likumu pasludināja 1799. gadā: kad divi vai vairāki elementi reaģē viens ar otru, veidojot savienojumu, tie vienmēr savienojas atbilstoši noteiktām un nemainīgām masas proporcijām.
Lai gan viņa likums ierosināja, ka ķīmiskie savienojumi jāveido no dažāda svara daļiņām, no kurām katra ir attiecināma uz noteiktu elementu. bija britu zinātnieks Džons daltons (kuram mēs esam parādā terminu "krāsu aklums": kurš nevarēja redzēt dažas krāsas un bija viens no galvenajiem šī stāvokļa studentiem), kurš XNUMX. gadsimta sākumā pierādīja, ka, diviem elementiem apvienojoties, veidojot savienojumus, elementa daudzums ir apvieno ar daudzumiem, kas ir viens otra daudzkārtņi, kas attiecas viens uz otru kā mazi veseli skaitļi.
Būtībā, ja es savienoju 12 gramus oglekļa ar 16 gramiem skābekļa, es iegūstu oglekļa monoksīdu (CO), bet, ja es apvienoju pirmo ar divreiz vairāk skābekļa, es iegūstu oglekļa dioksīdu (CO2). Ar tādu pašu oglekļa masu oglekļa dioksīds satur divas reizes vairāk skābekļa nekā oglekļa monoksīds. No tā izriet, ka kombinācijas koeficienta vērtība ir puse.
Sīkas "lietiņas" cilvēka acij, atomi
Lai izskaidrotu savu likumu, Daltons pieņēma, ka katrs elements sastāv no sīkām, cilvēka acij neredzamām lietām, kas sver vienādi. Viņš tos sauca par "atomiem", pārņemot grieķu vārdu, ko izmanto, lai definētu kaut ko nedalāmu.

ieviešot kārtību
Dažu gadu laikā Lavuazjē, Prusts un Daltons bija formalizējuši trīs klasiskos ķīmijas likumus (svara likumi), demonstrējot zinātniskās metodes potenciālu un straujo progresu fundamentālā disciplīnā, lai saprastu, kā darbojas pasaule, taču bija nepieciešams ieviest kārtību starp tik daudziem jaunumiem.
Viens no pirmajiem, kas to izdarīja, bija zviedru ķīmiķis Jenss Jēkabs Berzeliuss, kurš ieviesa elementu saīsinājumus, izmantojot vienu vai divus burtus, piemēram, "C" apzīmē oglekli un "Fe" apzīmē dzelzi. Saīsinājumiem viņš pievienoja ciparus, lai norādītu dažādu elementu proporcijas: piemēram, "2" H.2O, kas norāda uz divām ūdeņraža daļām, kas savienotas ar vienu skābekļa daļu, veidojot ūdens molekulu. Šie burti un cipari būtu nonākuši elementu periodiskajā tabulā un joprojām ir būtiski mūsdienās.
Bērzeliuss bija diezgan radošs un zinātkārs puisis.. Uzzinājis par itāļa Alesandro Voltas izgudroto elektrisko akumulatoru, kas ķīmiskās reakcijas rezultātā ražoja elektrību, viņš sāka eksperimentēt, lai mēģinātu iegūt pretēju efektu. Viņš izmantoja elektrību no akumulatora, lai šķīdumos izraisītu ķīmiskas reakcijas, ko sauc par elektrolīzi.
Šis paņēmiens, ko izmantojuši vairāki citi zinātnieki, izrādījās noderīgs dažādu iepriekš nezināmu ķīmisko elementu atklāšanā. Dažu gadu laikā tika identificēti elementi, kuru pastāvēšana tagad, šķiet, vienmēr ir uzskatīta par pašsaprotamu, piemēram, nātrijs, magnijs, kālijs un kalcijs. Lavuazjē uzskaitītajiem trīsdesmit elementiem tika pievienoti desmitiem jaunu elementu, kas radīja jaunus jautājumus: Cik daudz elementu patiesībā ir dabā? Kā mēs varam atklāt citus? Vai ir vielas, kuras, mūsuprāt, ir citu elementu apvienošanās rezultāts un kuras tā vietā pašas ir elementi?

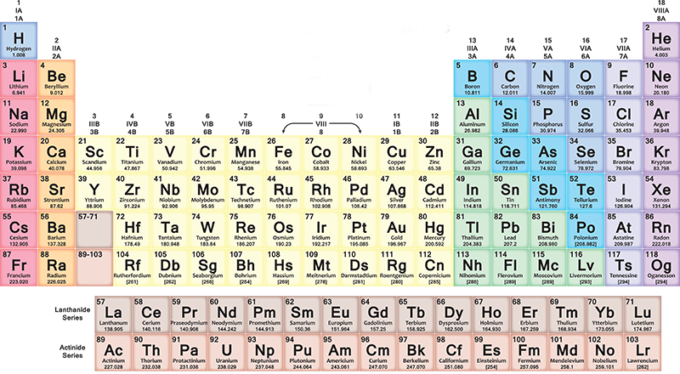
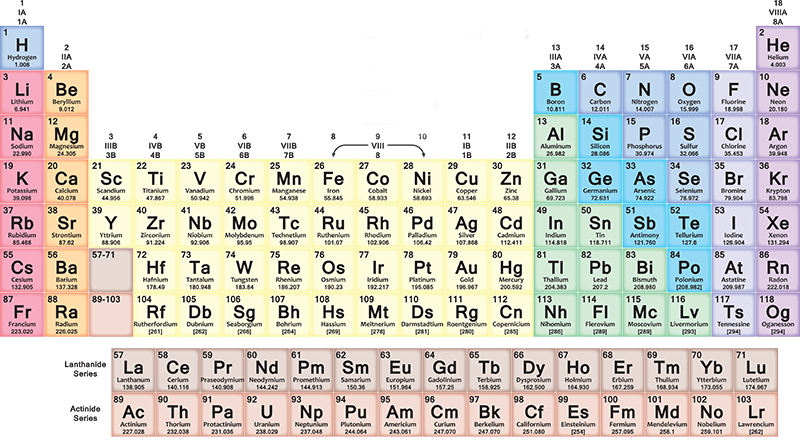
periodiskā tabula
Turpinoties sacensībām par elementiem, daudzi zinātnieki sāka brīnīties kā pasūtīt un izprast savus jaunatklājumus. Lai to izdarītu, jums bija jāpārbauda atsevišķas vielas un jāsalīdzina to īpašības, meklējot kopīgas lietas. Tika atklāts, ka dažus elementus var sagrupēt trijos un sakārtot pēc atomu svara: centra elementam vienmēr bija svars, kas vienāds ar vidējo svaru starp diviem vieglākajiem un smagākajiem partneriem.
1860. gadsimta XNUMX. gadu sākumā ķīmiķu rīcībā bija trīs pamatlikumi, desmitiem elementu, zināšanas par kādu no tiem atkārtotiem raksturlielumiem, bet nebija nevienas kataloģizācijas sistēmas, lai pārvietotos pa pasauli, ko viņi bija atklājuši. Ķīmijas sakārtošana kļuva gandrīz par apsēstību a Ķīmijas profesors Sanktpēterburgas Universitātē Krievijā: Dmitrijs Ivanovičs Mendeļejevs. 1869. gada februāra beigās un marta sākumā Mendeļejevs strādāja, lai izprastu elementus. Tā burtiski bija pastāvīga apņemšanās: viņš strādāja dienu un nakti, galu galā zaudējot laika izjūtu un vēlāk teica, ka galvenā ideja par ķīmijas mīklas atrisināšanu viņam radās pēc īsa sapņa.
Periodiskās tabulas izveide
Mendeļejevs izveidoja tabulu, kurā elementi tika uzskaitīti pēc precīza kritērija, kurā tika ņemtas vērā attiecības starp tā pazīmēm. Viņa sistēma bija labāka nekā iepriekšējie mēģinājumi viena vienkārša iemesla dēļ: tā bija godīgāka. Citiem vārdiem sakot, tā apsvēra iespēju, ka ir jāatklāj citi elementi, un tāpēc ir normāli, ka dažas shēmas kastes ir tukšas. Mendeļejevs izpelnījās lielu kritiku par šo caurumu atstāšanu, taču nākamo gadu desmitu atklājumi viņam pierādīs taisnību.
Tabulā ne tikai tika apsvērta iespēja atklāt jaunus elementus: arī apšaubīja, vai daži mērījumi veikti līdz tam laikam daži no tiem bija precīzi. Tabulā Mendeļejevs apgrieza dažus elementus, kas atbalsta šo teoriju. Dažos gadījumos precīzāki mērījumi pierādīja, ka viņam ir taisnība, citos gadījumos nē, parādot, ka zinātniekiem tajā laikā vēl kaut kas trūka par atomu svaru.

Mendeļejeva tabulas evolūcija
Periodiskās elementu tabulas, iespējams, ķīmiķu iecienītākā režģa, skaistums ir tāds, ka tas neizskatās pēc vienota raksta. Dažās rindās ir nedaudz vienumu, savukārt citās ir 18 vienumi. To sauc par "periodisku", jo Mendeļejevs izmantoja ķīmisko īpašību atkārtošanos, grupējot elementus ar līdzīgām ķīmiskajām īpašībām..
Tā kā turpmākajos gados tika atklāti jauni elementi, tostarp pārsteidzošās cēlgāzes (piemēram, hēlijs), inertas un tāpēc grūti nosakāmas, Mendeļejeva tabula izrādījās lielisks sākumpunkts visaptverošas elementu shēmas uzlabošanai, neskatoties uz to, ka sarežģījumi, ko rada jaunas atziņas un zinātniski pierādījumi. XNUMX. gadsimta beigās, piemēram, atklājās, ka atomi var zaudēt gabalus, liekot domāt, ka tās pašas sastāvēja no mazākām, vēl nenovērotām daļām.
ķīmiskā struktūra
Atkal dažu gadu desmitu laikā ķīmija veica lēcienus un robežas, kā rezultātā tika formulētas atomu struktūras teorijas. Viņi atklāja lietas, kuras mēs šodien uzskatām par pašsaprotamām, piemēram protonu (pozitīvi lādētu), neitronu (bez lādiņa) un elektronu (negatīvi lādētu) esamība, tas ir, subatomiskās sastāvdaļas. Tas noveda pie atomu skaita noteikšanas, kas norāda protonu skaitu, kas atrodas atoma kodolā.
Tomēr, 1869. gadā būdams bez zināšanām, Mendeļejevs bija sakārtojis savu shēmu pēc atomu svara (lai gan ar zināmu aizstāšanu elementu secībā, lai kopējais izkārtojums būtu piemērots). Netīšām, Mendeļejevs bija sakārtojis elementus atomu skaita secībā, gadus pirms šī jēdziena ieviešanas. Atomu skaitļu aizstāšana tabulas vērtībās radīja periodiskās tabulas galīgo secību, ko mēs zinām šodien. Papildus atoma struktūras atklāšanai 18. gadsimtā kvantu mehānika būtu izraisījusi turpmākus periodiskās tabulas evolūcijas un uzlabojumus, kas ir atspoguļoti pašreizējā XNUMX kolonnu modelī.
Kā izveidot un lasīt periodisko tabulu
Periodiskajā tabulā elementi tiek ievietoti pakāpeniski katrā rindā (periodā) no kreisās puses uz labo atbilstoši to atomu skaitļu secībai: katra jauna rinda sākas pēc cēlgāzes. Pirmais elements rindā vienmēr ir sārmu metāls, kura atomu skaits ir viens lielāks nekā elementam, ar kuru beidzās iepriekšējā rinda. Vispārīgāk, septiņās tabulas rindās metāli atrodas kreisajā pusē un cita veida elementi ir labajā pusē.
tā virzoties pa labi, jūs atradīsiet arvien smagākus priekšmetus, ar dažādiem raksturlielumiem no metāla līdz gāzei. Kad jūs sasniedzat rindas beigas un sākat nākamo, vienmēr no kreisās uz labo pusi, sadalījums tiek atkārtots cikliski. Viss atgriežas ar zināmu harmoniju, kas tevi pārsteigs, ja mēģināsi izlasīt tabulu, skatoties uz to.
Kolonnās (grupās vai saimēs) ir elementi ar līdzīgām ķīmiskajām īpašībām. Piemēram, ir tāda pati ārējā elektronu konfigurācija, tas ir, elektroni, kas uzvedas vienādi ap savu atomu kodolu. Ir 18 grupas, un tās svārstās no sārmu metālu grupas līdz cēlgāzu grupai.
Ne visi elementi ir dabiski
Elementi ar atomu skaitu no 1 līdz 118 aizņem visas septiņas periodiskās tabulas rindas: pirmie 94 visi ir dabiski, savukārt tie no 95 līdz 118 ir iegūti mākslīgi. Joprojām turpinās jaunu vienumu izstrādes izpēte, kā arī pašreizējā shēmas izkārtojumā ir jāatrisina dažas problēmas.
Neraugoties uz dažiem uzlabojumiem, kopumā 150 gadu pastāvēšanas laikā elementu periodiskā tabula ir izrādījusies būtiska ne tikai elementu sakārtošanai, kas to visu veido, tostarp acis, ar kurām lasāt šos vārdus, bet arī analizēt reakciju ķīmiju, atklāt sakarības starp dažādiem savienojumiem un pētīt kodolfiziku. Tabulas rindas un kolonnas ir nesalīdzināma sintēze par to, kas bija zinātniskais pētījums, kas ļāva to izveidot, un zināmā mērā par to, kas būs.