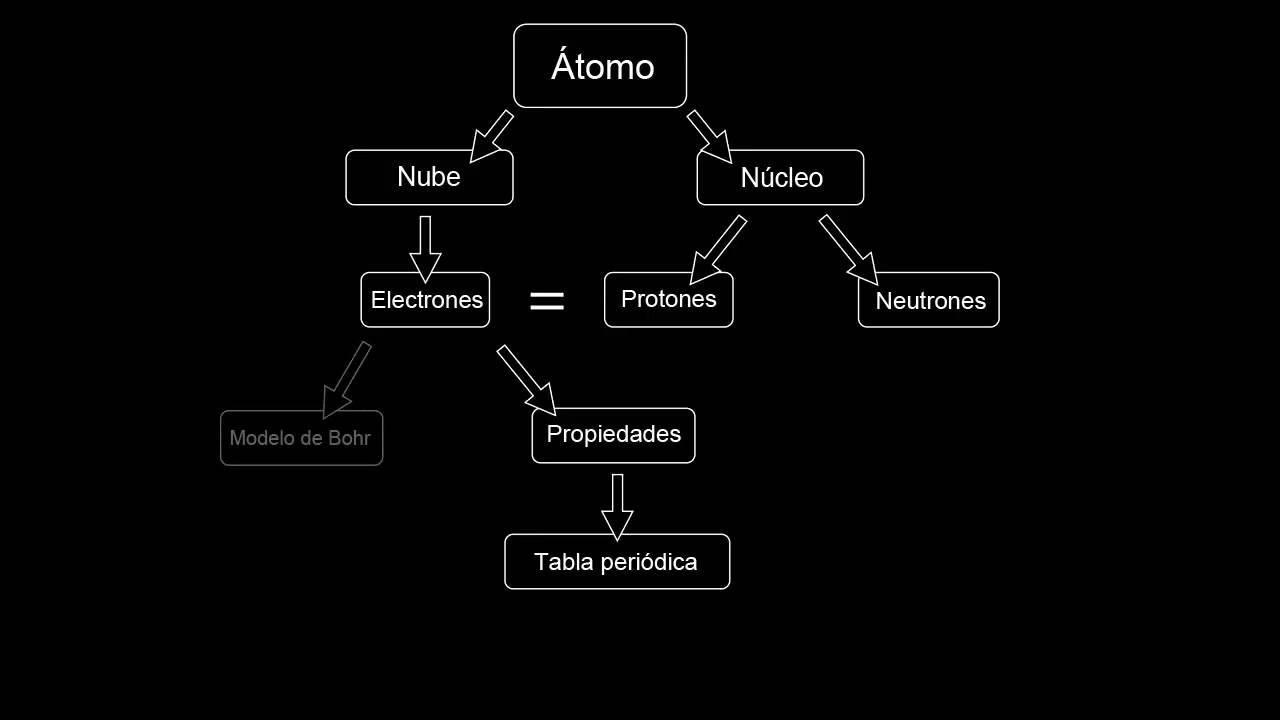
El model atòmic de Bohr tracta d'explicar la manera com es troben disposats els elements dins d'un àtom. Amb ell, es va poder inferir que el moviment dels àtoms en òrbites circulars i el seu desplaçament entre una òrbita i una altra eren capaços de produir augments o pèrdues denergia. Aquí podràs conèixer més sobre la teoria atòmica de Bohr.

Model atòmic Bohr
També va rebre el nom de model Rutherford-Bohr. Va ser desenvolupat el 1913, a partir del model de Rutherford, que encara que va ser reeixit i revolucionari, presentava alguns conflictes amb les lleis de Maxwell i amb les lleis de Newton, perquè arribava a la consideració que tots els àtoms eren inestables.
El model atòmic de Rutherford es basava que els electrons en moviment que posseïen una càrrega elèctrica de signe negatiu haurien de propagar radiació electromagnètica, segons les lleis d'electromagnetisme. Suposant que això fos així, la pèrdua d'energia faria que els electrons comprimissin la seva òrbita, desplaçant-se en espiral cap al centre de l'àtom, per després col·lapsar al nucli.
Noves idees
El model atòmic de Bohr va donar la solució a aquest problema, adduint que els electrons circulen en òrbita al voltant del nucli, però només en algunes orbites permeses i amb una energia determinada que és proporcional a la constant de Planck.
A les òrbites permeses se'ls va donar el nom de capes d'energia o nivells d'energia. Això vol dir, que la capacitat d'energia d'un electró a l'interior d'un àtom no és contínua, sinó quantificada en un nivell determinat.
Aquests nivells es troben identificats amb un nombre quàntic n (n = 1, 2, 3, i més) i d'acord amb Bohr, aquest nombre quàntic es podria establir utilitzant la fórmula de Ryberg, que és una regla creada l'any 1888 pel físic suec Johannes Ryberg per representar les longituds d'ona de les línies espectrals de molts elements químics.
Aquest patró de nivells denergia indicava que els electrons només poden incrementar o decréixer en la seva energia si aconsegueixen saltar duna òrbita determinada a una altra i quan això passa, lelectron irradiaria o absorbiria radiació electromagnètica en el transcurs.
El model atòmic de Bohr va ser una modificació del model de Rutherford. Per això, les particularitats d'un nucli central petit i amb la majoria de la massa es van persistir. De la mateixa manera, els electrons feien el seu moviment orbital al voltant del nucli, de manera semblant als planetes al voltant del sol, però els seus moviments orbitals no eren plans.
Principis bàsics del model atòmic de Bohr
Les partícules carregades amb energia elèctrica de signe positiu es troben en quantitats molt petites, si les comparem amb el volum de l'àtom i engloben la secció de massa més gran de l'àtom. Mentre que els electrons, que tenen càrrega elèctrica de signe negatiu, es desplacen al voltant del nucli en òrbites circulars, que ja tenen una mida i energia predeterminats. Per això, no existeixen en una posició intermèdia entre les òrbites.
L'energia de l'òrbita té una relació proporcional a la seva mida. L'energia menor es troba a l'òrbita de perímetre més petit. Com més allunyat es trobi un nivell d'energia del nucli, més gran serà la quantitat d'energia que posseeix.
Els nivells denergia tenen diferents quantitats delectrons. Com més baix sigui el nivell d'energia, també serà menor la quantitat d'electrons que posseeix. Per exemple, al nivell 1 es trobaran fins a 2 electrons, al nivell 2 hi haurà fins a 8 electrons, i així contínuament. Aleshores, l'energia s'irradia o s'absorbeix en el moment en què un electró canvia d'una òrbita a una altra.
Consideracions addicionals del Model atòmic de Bohr
La raó de ser del model atòmic de Bohr va ser explicar que la matèria es manté estable, cosa que no feien els models atòmics anteriors, així com els espectres d'absorció i irradiació dels gasos.
El de Bohr va ser el primer a utilitzar el concepte de quantització, cosa que el col·loca entre un model de mecànica clàssica, com les Aportacions de Blaise Pascal i un model de mecànica quàntica. Va millorar el model de Rutherford en incorporar descobriments de quantització fets per Max Planck uns anys abans i les teories d'Albert Einstein.
Tot i les seves deficiències, el model atòmic de Bohr va ser l'antecedent al naixement de la mecànica quàntica que van iniciar Schrödinger i altres científics, així com la Teoria Quàntica de Plank.
Limitacions i Errors al model de Bohr
El model no explica la raó per la qual els electrons se circumscriuen de forma única a determinades òrbites.
En el model es va afirmar que els electrons tenien un radi i una òrbita coneguts, cosa que el Principi d'Incertesa de Werner Heisenberg desmentiria deu anys després.
El model atòmic de Bohr tenia la capacitat de reproduir el comportament dels electrons als àtoms d'hidrogen, però els seus patrons no resultaven aplicables als àtoms d'altres elements que tenien més electrons.
Aquest model atòmic presentava incongruències quan es tractava d'explicar l'efecte Zeeman. Aquest efecte és el que es pot veure quan les línies espectrals resulten dividides en dues o més, davant de la presència d'un camp magnètic extern i immòbil.
Igualment, el model atòmic de Bohr subministra un valor erroni per al moment angular orbital de la matèria en estat fonamental.
Totes aquestes raons van conduir que el model atòmic de Bohr fos substituït anys després per la teoria quàntica, producte del treball científic de Heisenberg i Schrodinger.
Qui va ser Niels Bohr?
Niels Bohr va ser un físic nascut a la ciutat de Copenhaguen, Dinamarca, a l'octubre de l'any 1885. El seu pare era professor universitari i la seva mare era filla d'una família adinerada. Va tenir l'oportunitat d'entrar a la Universitat de Copenhaguen l'any 1903, amb la finalitat d'estudiar física, però també va fer estudis en astronomia i matemàtiques. L'any 1911 va aconseguir obtenir el títol de doctor.
També el 1911, gràcies a haver guanyat una beca de la Fundació Carlsberg, que dedicava els seus recursos als estudis de l'àtom, va aconseguir viatjar a Londres i durant la seva estada va conèixer rellevants científics, com JJ Thomson i Ernest Rutherford.
L'any 1912, torna a Dinamarca, casant-se amb Margrethe Norlud, de la qual va tenir sis fills, un es va convertir en un reconegut físic que va guanyar el premi nobel el 1975, tal com el seu pare ho va fer anys abans.
Establert a Dinamarca ia causa de la poca popularitat de la física al seu país, es va veure obligat a impartir classes a alumnes de medicina, fet que va disgustar a Bohr, tornant després a Manchester, Anglaterra, on Rutherford li havia ofert un lloc. Va romandre a Londres fins a 2 anys després d'iniciada la primera guerra mundial.
Director de Física i Premi Nobel
L'any 1916 va ser nomenat director de física teòrica de la Universitat de Copenhaguen, que va ser un lloc creat especialment per a ell. El 1918 va convèncer el govern perquè es creés l'institut danès de física teòrica, avui conegut com l'Institut Niels Bohr, que va començar el seu camí el 1921, tenint-lo com a director principal.
Se li va concedir el premi Nobel de Física l'any 1922, pel seu treball a la investigació dels àtoms i les radiacions que emeten. Després, el 1924, Bohr es va reunir amb Heisenberg a Dinamarca i amb posterioritat va tenir l'oportunitat de rebre científics com Paul Dirac i Erwin Schrödinger, que van aconseguir perfilar el pensament i la interpretació de la mecànica quàntica de Copenhaguen.
Bohr va morir el 18 de novembre de 1962 a Carlsberg, Dinamarca, però va ser el pare de la Física moderna del seu país.
Esperem que aquesta lectura sobre el model atòmic de Bohr hagi resultat interessant i us convidem a conèixer més del nostre contingut científic.