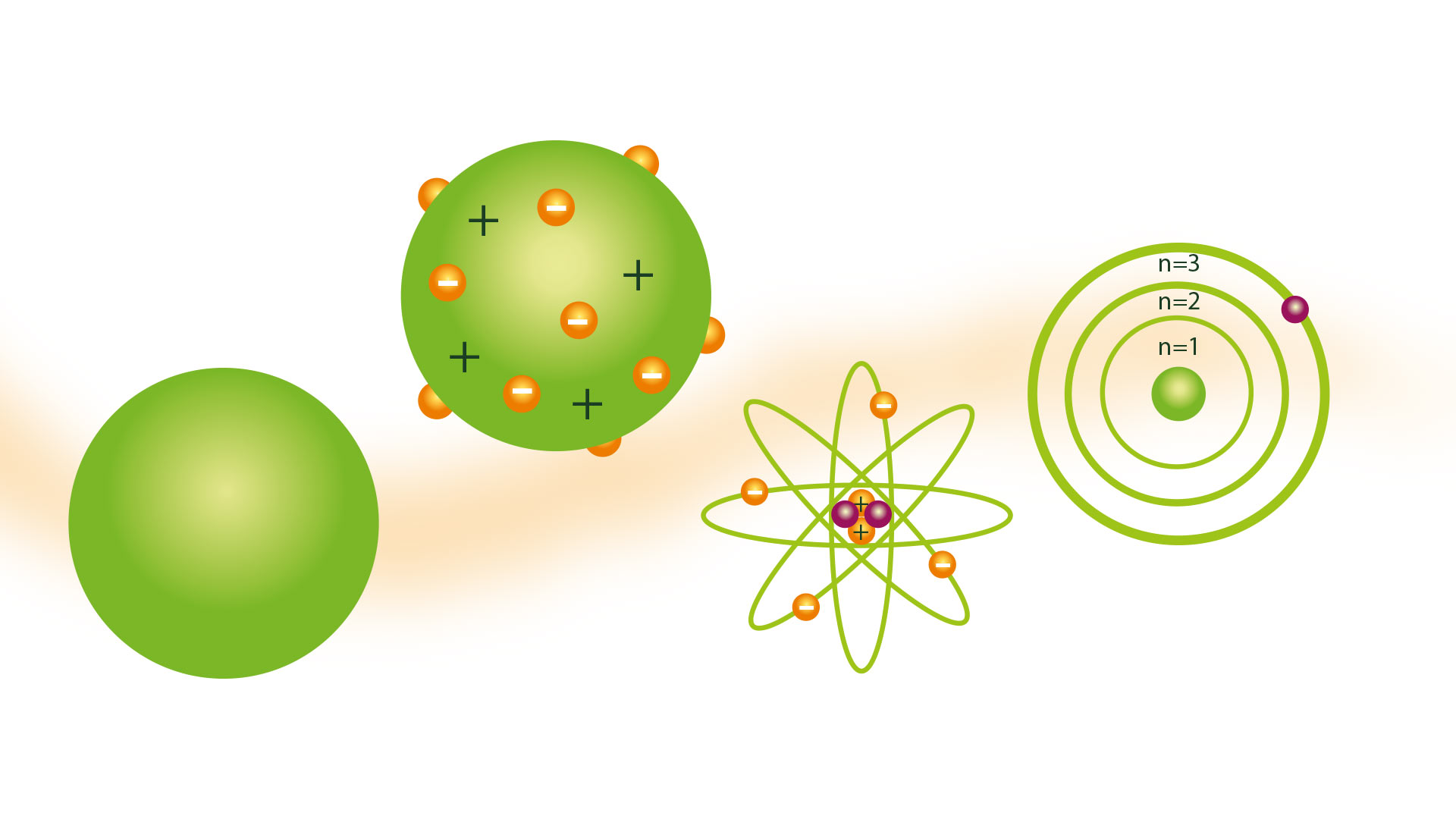
Многи научници током векова нису делили представу о атому коју је представио грчки филозоф Демокрит. Али 1804. године атомски модел Далтона, на основу теорија грчких атомиста, што је и прихваћено.

Далтонов атомски модел
После атомистичке мисли и грчких филозофских идеја, прошло је око 2 хиљаде година док нова атомска теорија није постала позната научном свету. Његово порекло је у истраживању Џона Далтона, који је био британски физичар, хемичар и метеоролог и био је промотер прве модерне атомске теорије.
Могло би се рећи да је Далтон био оно што се звало потпуни научник, јер његове студије нису биле ограничене само на физику, напротив, био је и надалеко познат по својим истраживањима о немогућности да се боје људским оком препознају. стање које је захваљујући њему данас познато као далтонизам.
Његов атомски модел је био познат као модел билијарске лопте и представљен је 1804. Далтон је био научни истраживач и његов модел је био производ до којег је дошао након закључака који су били резултат више експеримената које је спровео са гасовима. Он је био претеча теорија као што су Рутхерфордов атомски модел.
Узимајући за основу закључке и ефекте свог рада, Далтон је успео да докаже да атоми о којима су Грци говорили заиста постоје, што је питање које је Атомска теорија Демокрита само је скицирао, успевши да успостави прву научно утемељену теорију постојања атома у историји модерне физике.
Основни принципи Далтоновог атомског модела
Далтонов атомски модел је био први визуелизовани покушај механизма, конформације и локације атома, замишљен између 1803. и 1807. године, Џон Далтон му је први дао име атомска теорија и на основу њега направио следеће премисе:
први постулат
Утврдио је да се сва материја састоји од елементарних честица, званих атоми, и да се не може ни поделити ни уништити. Такође се не могу створити или променити у хемијској реакцији.
други постулат
Атоми који чине било који елемент су идентични једни другима, не само по тежини, већ и по другим карактеристикама. Дакле, сви атоми кисеоника су апсолутно једнаки. Уместо тога, атоми различитих елемената разликују се једни од других по својој тежини. Захваљујући овом постулату, дошло је до сазнања о релативној атомској тежини, кроз поређење различитих атома са оном водоника, што је по Далтону било најједноставније.
трећи постулат
Атоми се не могу поделити, без обзира на врсту хемијског дејства на њих. Комбинација истих или различитих атома ће довести до сложенијих једињења или супстанци, али увек почевши од атома као минималне основне јединице материје.
четврти постулат
Комбинација атома један са другим, да би се формирала једињења, увек ће открити однос који се може изразити једноставним и потпуним бројевима. Никада у разломцима, пошто се атоми не могу поделити. Тако се дешава са кисеоником, који настаје од два једнака атома (О2), или са водом која су два једнака и један различита (Х2О).
пети постулат
Комбиновањем атома насумичних елемената у различитим количинама могу се формирати бројна различита једињења. Ово је једини начин на који се може објаснити да је, почевши од коначног броја атома, изграђена сва материја у свемиру. Као пример ове идеје, атом угљеника и два атома кисеоника ће формирати једињење (ЦО2), али само један од сваког елемента ће формирати различито једињење (ЦО).
шести постулат
Сва хемијска једињења настају када се атоми два или више различитих елемената споје, на сталан и једноставан начин. Али, према Далтонова теорија, атоми истог елемента у почетку не показују никакав афинитет једни према другима, само у присуству различитих атома.
Далтонови закони
Као последица ових постулата, формулисани су следећи закони:
- Сва материја је састављена од атома.
- Апсолутно све што је познато је састављено од атома, како на земљи тако и у познатом универзуму. Сваки од елемената се састоји од атома.
- Атоми су недељиви и неуништиви.
- Атоми су најмање честице материје.
- Сви атоми датог елемента су идентични.
- У одређеном елементу сви његови атоми имају исту масу и исте карактеристике.
- Атоми различитих елемената се разликују по маси и својствима.
- Сваки елемент се састоји од атома различитих карактеристика и масе.
- Једињења се састоје од комбинације две или више различитих врста атома.
- Конкретно једињење увек има исте врсте атома комбинованих и у истим размерама.
- Хемијска реакција је преуређење атома.
- Хемијске реакције су производ раздвајања, спајања или преуређивања атома. Али, атоми једног елемента никада не постају атоми другог елемента као резултат хемијске реакције.
Додатна разматрања Далтоновог атомског модела
Упоредо са стварањем основних принципа наведених горе, Далтон је предложио да атоми два елемента који су међусобно повезани да би формирали молекуле поштују Закон одржања масе. То значи да су број и типови атома који се налазе у молекулу исти као и број и типови атома елемената који се користе у хемијској реакцији.
Још једна релевантна изјава ове теорије био је Закон вишеструких пропорција, према којем када су два атома два елемента коњугирана, коњугација се може десити само према односу целих бројева као што су 1:1, 2:1, 2:2 , и тако даље. Ако се за пример узме вода, види се да се Х2О комбинује у односу 2:1, што значи да има два атома водоника и један кисеоник.
Због тога није могуће да се другачији удео ових елемената може користити за производњу воде. Није могуће произвести воду користећи 3 атома водоника и два атома кисеоника (3:2).
Далтон је такође успео да направи „Табелу атомских тежина“ и користећи податке из те табеле, могао је да постави елементе у распоред одређен тежином њихових елемената, из поређења са водоником, који је најлакши елемент. , који је први у вашој табели и има атомски број 1.
Модел лопте за билијар
Последица идеје да су атоми најмање честице материје била је могућност да их замишљамо као чврсте и тврде сфере, за које су многе његове представе направљене по моделима направљеним од дрвених сфера, захваљујући којима је добио билијарску лопту. Назив модела.
Ланац резоновања Далтонове теорије био је у стању да на научно задовољавајући начин објасни два закона: закон константних пропорција, према којем је пропорционалност фиксирана између реагујућих супстанци, и закон вишеструких пропорција, према којем су пропорције између супстанци које реагују увек ће то чинити у целим бројевима.
Кроз ову формулацију је такође било могуће објаснити постојање бројних елементарних супстанци, почевши од коначног скупа саставних честица. Касније је побољшана Радерфордовом теоријом и Боров атомски модел
Далтонов атомски модел је у суштини једноставан комбинаторни модел, који би могао дати разјашњење готово читаве хемије свог времена и са њом темељ за развој и будуће иновације у области хемије и у разним другим областима науке.
Далтонови експерименти
За разлику од атомиста, који су само користили своју логику да концептуализују атом, Далтон је своје тврдње засновао на великом броју експеримената који су доказали постојање атома, спроведених у потпуности из перспективе хемије. Неколико најпознатијих су били:
Извео је експерименте са материјом у гасовитом стању, посматрајући ефекте притиска тог стања материје, дошавши до закључка да се атоми од којих се састоје гасовите материје налазе у непрекидном случајном кретању.
Неки од његових експеримената били су засновани на мешавини елемената за прављење молекула једињења, чији резултати су му омогућили да тврди да ће дато једињење увек бити састављено од истих елемената у истим пропорцијама и по његовом закону вишеструких пропорција.
Прихватање Далтоновог атомског модела
Далтонову атомску теорију широко су прихватили многи научници његовог времена без много времена за њу и постала је основа за неке делове данашње атомске теорије.
Иако данас научници такође знају да атоми нису најситније честице материје, јер, као што је познато, атоми садрже неколико врста мањих честица, као што су протони, неутрони и електрони. Далтонова теорија је одмах успостављена као теоријска основа за хемију.
Ограничења и грешке у Далтоновој теорији
Далтон је имао хипотезу да су атоми свих елемената остали индивидуални, због чега није могао да схвати да у неким елементима атоми постоје у молекулима, као што је случај чистог кисеоника који постоји као О2, тј. молекул истог елемента са два атома кисеоника.
Исто тако, његова идеја да је најједноставније једињење између два елемента константно један атом сваког од њих била је погрешна. Грешка која га је навела да закључи да је израз за воду био ХО уместо Х2О.
Чињеница да је опрема коју је користио за своје експерименте била врло основна довела је Далтона до неколико погрешних закључака. У својим почецима давао је кисеонику вредност 5.5, што значи да је био 5.5 пута обимнији од атома водоника, који је користио као референцу. Међутим, успео је да исправи те вредности годинама касније, дајући кисеонику вредност од 7, упркос чињеници да су други истраживачи његовог времена давали кисеонику вредност 8.
Утицај Далтонове теорије
Истина је да је тренутна атомска теорија достигла нивое који су били неописиви пре неколико година, али Далтонов геније је у томе што су суштински принципи његове теорије још увек на снази у одређеним аспектима. Међутим, данас је познато да се атоми могу раздвојити реакцијама на нуклеарном нивоу, али то не значи да више не важи Далтонова изјава да се не могу раздвојити хемијским реакцијама.
Осим тога, данас је познато и да немају сви атоми истог елемента исту масу, пошто је било могуће доказати да постоје изотопи, а то су атоми са додатним неутронима, и да имају већу масу чак и када је исто.елемент.
Далтонова биографија
Џон Далтон је рођен у Енглеској 6. септембра 1766. године, његова породица је била скромна, а рано образовање стекао је од родитеља и школе у његовом граду. Због порекла и економског стања породице, морао је да почне да ради са 10 година, на кућној служби, мада се наводи и да је у школи почео да предаје са 12 година, а да је са 14 постао вешт латинским језиком.
Далтон је наставио да предаје и прима неформална упутства од инструктора у области у којој је живео, а када је напунио 27 година добио је именовање за професора математике и природне филозофије на малом универзитету у Манчестеру, позицију на којој је наставио неколико година.7 година, док не донесем одлуку да постанем приватни наставник за те исте предмете.
Научни доприноси
Без сумње, међу његовим најрелевантнијим доприносима је његова теорија атома, али Џон Далтон је спровео студије и експерименте на:
- Метеорологија.
- Мерење висина планина.
- Далтонизам, стање које је касније у његову част названо далтонизам.
- Неки закони који се односе на гасове.
И објавио је многе друге публикације својих радова о мањим темама, попут оне која се односи на боју неба, па чак и на енглеску граматику.
Далтон је био човек резервисаног карактера и никада се није женио. Посветивши се искључиво свом истраживању, водио је скроман живот без велике гужве. Године 1837. и 1838. патио је од напада због којих је постао нем, али га то није спречило да настави да истражује, све до године своје смрти, 1844.