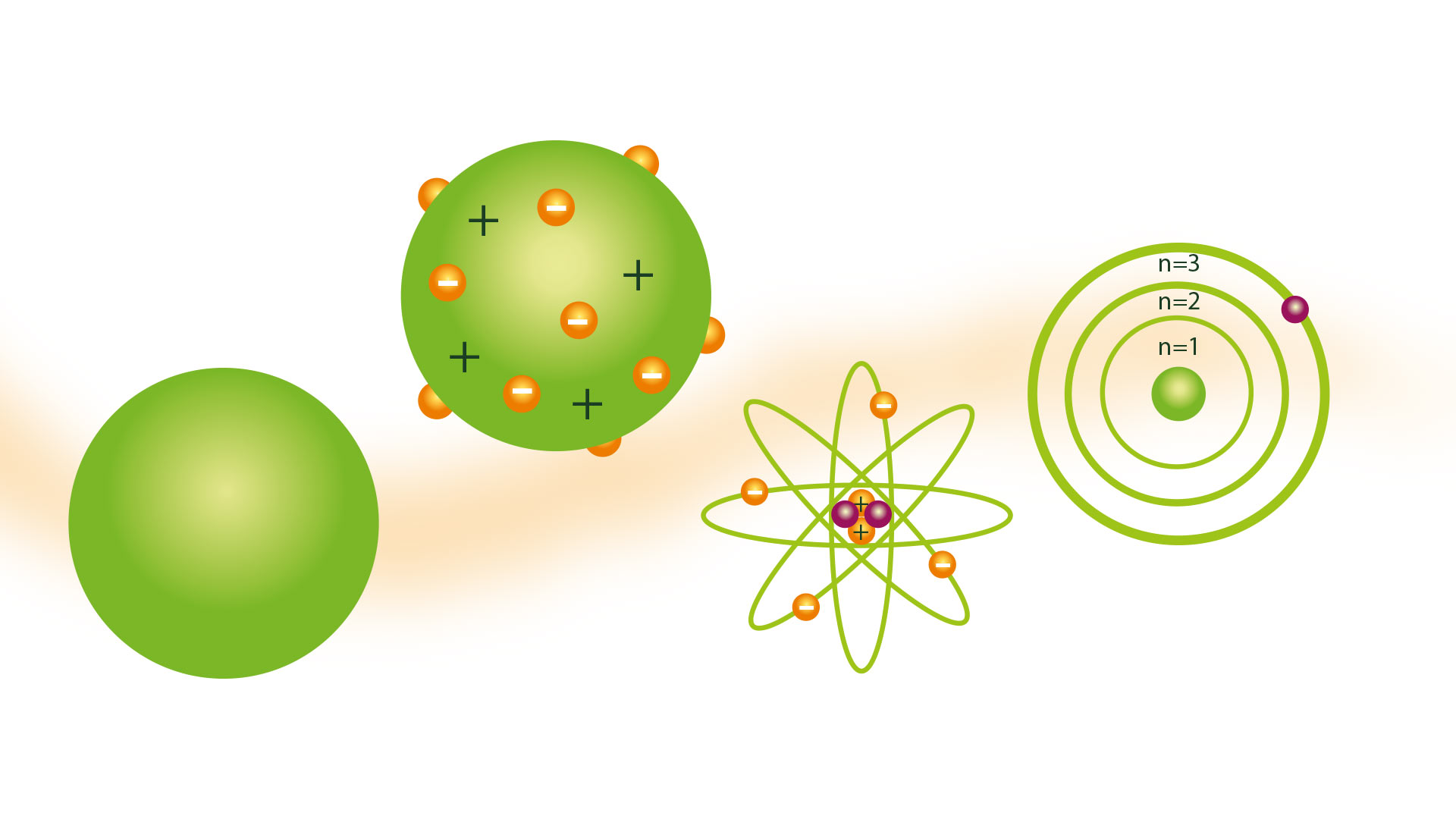
A noção de átomo apresentada pelo filósofo grego Demócrito não foi compartilhada por muitos cientistas ao longo dos séculos. Mas no ano de 1804, o dalton Modelo atômico, baseado nas teorias dos atomistas gregos, o que foi aceito.

Modelo atômico de Dalton
Após o pensamento atomístico e as ideias filosóficas gregas, cerca de 2 mil anos se passaram até que uma nova teoria atômica fosse divulgada ao mundo científico. Sua origem foi nas investigações de John Dalton, que foi um físico, químico e meteorologista britânico e foi o promotor da primeira teoria atômica moderna.
Pode-se dizer que Dalton era o que se chamava de um cientista completo, pois seus estudos não se limitavam à física, pelo contrário, ele também foi amplamente reconhecido por suas pesquisas sobre a impossibilidade de poder apreciar as cores pelo olho humano, uma condição que, graças a ele, hoje é conhecida como Daltonismo.
Seu modelo atômico ficou conhecido como modelo da bola de bilhar e foi apresentado em 1804. Dalton era um pesquisador científico e seu modelo foi o produto a que chegou após as conclusões resultantes de múltiplos experimentos que realizou com gases. Ele foi o precursor de teorias como a Modelo atômico de Rutherford.
Tomando como base as conclusões e efeitos de seu trabalho, Dalton conseguiu provar que os átomos de que os gregos falavam realmente existiam, questão que o Teoria Atômica de Demócrito ele havia apenas esboçado, sendo capaz de estabelecer a primeira teoria cientificamente fundamentada da existência do átomo na história da física moderna.
Princípios Básicos do Modelo Atômico de Dalton
O modelo atômico de Dalton foi a primeira tentativa visualizada do mecanismo, conformação e localização dos átomos, concebido entre 1803 e 1807, John Dalton primeiro deu-lhe o nome de teoria atômica e com base nele, fez as seguintes premissas:
primeiro postulado
Ele determinou que toda a matéria é composta de partículas elementares, chamadas átomos, e não podem ser divididas nem destruídas. Eles também não podem ser criados ou alterados em uma reação química.
segundo postulado
Os átomos que compõem qualquer elemento são idênticos entre si, não apenas em peso, mas também em outras características. Portanto, todos os átomos de oxigênio são absolutamente iguais. Em vez disso, os átomos de diferentes elementos diferem uns dos outros pelo seu peso. Graças a este postulado, surgiu o conhecimento do peso atômico relativo, através da comparação de diferentes átomos com o do hidrogênio, que segundo Dalton era o mais simples.
terceiro postulado
Os átomos não podem ser divididos, não importa que tipo de ação química seja realizada sobre eles. A combinação de átomos iguais ou diferentes dará origem a compostos ou substâncias mais complexas, mas sempre a partir do átomo como unidade fundamental mínima da matéria.
quarto postulado
A combinação de átomos entre si, para formar compostos, sempre revelará uma relação que pode ser expressa em números simples e completos. Nunca em frações, pois os átomos não podem ser divididos. É o que acontece com o oxigênio, que é formado por dois átomos iguais (O2), ou com a água, que são dois iguais e um diferente (H2O).
quinto postulado
Ao combinar átomos de elementos aleatórios em diferentes quantidades, vários compostos diferentes podem ser formados. Esta é a única maneira pela qual se pode explicar que, a partir de um número finito de átomos, toda a matéria do universo foi construída. Para exemplificar essa ideia, um átomo de carbono e dois átomos de oxigênio formarão um composto (CO2), mas apenas um de cada elemento formará um composto diferente (CO).
sexto postulado
Todos os compostos químicos são formados quando os átomos de dois ou mais elementos diferentes são unidos, de forma constante e simples. Mas, segundo A teoria de Dalton, átomos de um mesmo elemento não exibem inicialmente nenhuma afinidade entre si, apenas na presença de átomos diferentes.
Leis de Dalton
Como consequência desses postulados, as seguintes leis foram formuladas:
- Toda a matéria é composta de átomos.
- Absolutamente tudo o que é conhecido é feito de átomos, tanto na Terra quanto no universo conhecido. Cada um dos elementos é formado por átomos.
- Os átomos são indivisíveis e indestrutíveis.
- Os átomos são as menores partículas da matéria.
- Todos os átomos de um determinado elemento são idênticos.
- Em um elemento específico, todos os seus átomos têm a mesma massa e as mesmas características.
- Átomos de diferentes elementos variam em massa e propriedades.
- Cada elemento é composto de átomos de diferentes características e massa.
- Os compostos são compostos de uma combinação de dois ou mais tipos diferentes de átomos.
- Um composto específico sempre tem os mesmos tipos de átomos combinados e nas mesmas proporções.
- Uma reação química é um rearranjo de átomos.
- As reações químicas são o produto de uma separação, união ou rearranjo de átomos. Mas, os átomos de um elemento nunca se tornam átomos de outro elemento como resultado de uma reação química.
Considerações Adicionais do Modelo Atômico de Dalton
Junto com a criação dos princípios básicos listados acima, Dalton propôs que os átomos de dois elementos que se relacionam entre si para formar moléculas respeitassem a Lei de Conservação da Massa. Isso significa que o número e os tipos de átomos encontrados em uma molécula são os mesmos que o número e os tipos de átomos dos elementos usados na reação química.
Otra relevante afirmación de esta teoría fue la Ley de Proporciones Múltiples, según la cual cuando se conjugan dos átomos de dos elementos, la conjugación sólo puede darse de acuerdo a una relación de números enteros como 1:1, 2:1, 2:2 , e assim por diante. Se a água for tomada como exemplo, pode-se observar que H2O se combina na proporção 2:1, o que significa que possui dois átomos de hidrogênio e um de oxigênio.
Portanto, não é possível que uma proporção diferente desses elementos possa ser usada para produzir água. Não é possível produzir água usando 3 átomos de hidrogênio e dois átomos de oxigênio (3:2).
Dalton também conseguiu criar uma "Tabela de Pesos Atômicos" e, usando os dados dessa tabela, conseguiu colocar os elementos em uma disposição determinada pelo peso de seus elementos, a partir de uma comparação com o hidrogênio, que é o elemento mais leve , que é o primeiro em sua tabela e tem o número atômico de 1.
O modelo de bola de bilhar
Uma consequência de ter a ideia de que os átomos eram as menores partículas da matéria foi poder imaginá-los como esferas sólidas e duras, para as quais muitas de suas representações foram feitas com modelos feitos com esferas de madeira, graças às quais recebeu a bola de bilhar nome do modelo.
A cadeia de raciocínio da teoria de Dalton foi capaz de explicar de forma cientificamente satisfatória duas leis: a Lei das proporções constantes, segundo a qual a proporcionalidade é fixada entre substâncias reagentes, e a Lei das proporções múltiplas, segundo a qual as proporções entre substâncias reagentes sempre o fará em números inteiros.
Através desta formulação também foi possível explicar a existência de inúmeras substâncias elementares, a partir de um conjunto finito de partículas constituintes. Mais tarde, foi aprimorado com a teoria de Rutherford e a Modelo Atômico Bohr
O modelo atômico de Dalton é um modelo combinatório essencialmente simples, que poderia elucidar quase toda a química de seu tempo e com ela a base para o desenvolvimento e inovações futuras no campo da química e em vários outros campos da ciência.
Experiências de Dalton
Ao contrário dos atomistas, que apenas usavam sua lógica para conceituar o átomo, Dalton baseou suas afirmações em um grande número de experimentos que provaram a existência de átomos, realizados inteiramente sob a perspectiva da química. Vários dos mais conhecidos foram:
Ele realizou experimentos com a matéria em estado gasoso, observando os efeitos da pressão desse estado da matéria, chegando à conclusão de que os átomos de que são compostas as matérias gasosas estão em um movimento fortuito ininterrupto.
Alguns de seus experimentos foram baseados em uma mistura de elementos para fazer moléculas de compostos, cujos resultados lhe permitiram afirmar que um determinado composto será sempre formado pelos mesmos elementos nas mesmas proporções e seguindo sua Lei das Múltiplas Proporções.
Aceitação do Modelo Atômico Dalton
A teoria atômica de Dalton foi amplamente aceita por muitos cientistas de seu tempo sem que muito tempo fosse necessário para isso e se tornou a base para algumas seções da teoria atômica de hoje.
Embora hoje os cientistas também saibam que os átomos não são as menores partículas da matéria, pois, como se sabe, os átomos contêm vários tipos de partículas menores, como prótons, nêutrons e elétrons. A teoria de Dalton foi imediatamente estabelecida como base teórica para a química.
Limitações e Erros na Teoria de Dalton
Dalton tinha a hipótese de que os átomos de todos os elementos permaneciam individuais, pelo que não conseguia perceber que em alguns elementos os átomos existem em moléculas, como é o caso do oxigênio puro que existe como O2, ou seja, uma molécula do mesmo elemento com dois átomos de oxigênio.
Da mesma forma, sua ideia de que o composto mais simples entre dois elementos é constantemente um átomo de cada um estava errada. Erro que o levou a deduzir que a expressão para água era HO em vez de H2O.
O fato de o equipamento que ele usou para fazer seus experimentos ser muito básico levou Dalton a várias conclusões erradas. Em seus primórdios, ele deu ao oxigênio um valor de 5.5, o que significa que era 5.5 vezes mais volumoso que o átomo de hidrogênio, que era o que ele usava como referência. No entanto, ele conseguiu corrigir esses valores anos depois, dando ao oxigênio um valor de 7, apesar de outros pesquisadores de sua época terem dado ao oxigênio um valor de 8.
Impacto da Teoria de Dalton
É verdade que a teoria atômica atual atingiu níveis indescritíveis há alguns anos, mas a genialidade de Dalton é que os princípios essenciais de sua teoria ainda são válidos em certos aspectos. No entanto, hoje sabe-se que os átomos podem ser separados por meio de reações no nível nuclear, mas isso não significa que a afirmação de Dalton de que eles não podem ser separados por meio de reações químicas não seja mais válida.
Além disso, hoje também se sabe que nem todos os átomos de um mesmo elemento têm a mesma massa, pois foi possível demonstrar que existem isótopos, que são átomos com nêutrons adicionais, e que eles têm uma massa maior mesmo quando o mesmo elemento.
Biografia de Dalton
John Dalton nasceu na Inglaterra em 6 de setembro de 1766, sua família era humilde e sua educação inicial foi de seus pais e de uma escola em sua cidade. Devido às suas origens e à condição económica da sua família, teve de começar a trabalhar aos 10 anos, servindo numa casa, embora também se diga que começou a lecionar numa escola aos 12 anos e que aos 14 se tornou proficiente em latim.
Dalton continuou a ensinar e receber instrução informal de instrutores na área em que vivia e, quando atingiu a idade de 27 anos, foi nomeado professor de matemática e filosofia natural em uma pequena universidade em Manchester, cargo em que continuou. por vários anos 7 anos, até que eu tome a decisão de me tornar um professor particular para essas mesmas disciplinas.
Contribuições Científicas
Sem dúvida, entre suas contribuições mais relevantes está sua teoria do átomo, mas John Dalton realizou estudos e experimentos sobre:
- Meteorologia.
- Medidas das alturas das montanhas.
- Daltonismo, uma condição que mais tarde foi chamada de Daltonismo em sua homenagem.
- Algumas leis relacionadas aos gases.
E fez muitas outras publicações de seus trabalhos sobre assuntos menores, como o relacionado à cor do céu e até mesmo à gramática inglesa.
Dalton era um homem de caráter reservado e nunca se casou. Dedicando-se exclusivamente à sua pesquisa, levou uma vida modesta, sem muito barulho. Nos anos de 1837 e 1838 sofreu convulsões que o tornaram mudo, mas isso não o impediu de continuar investigando, até o ano de sua morte, em 1844.