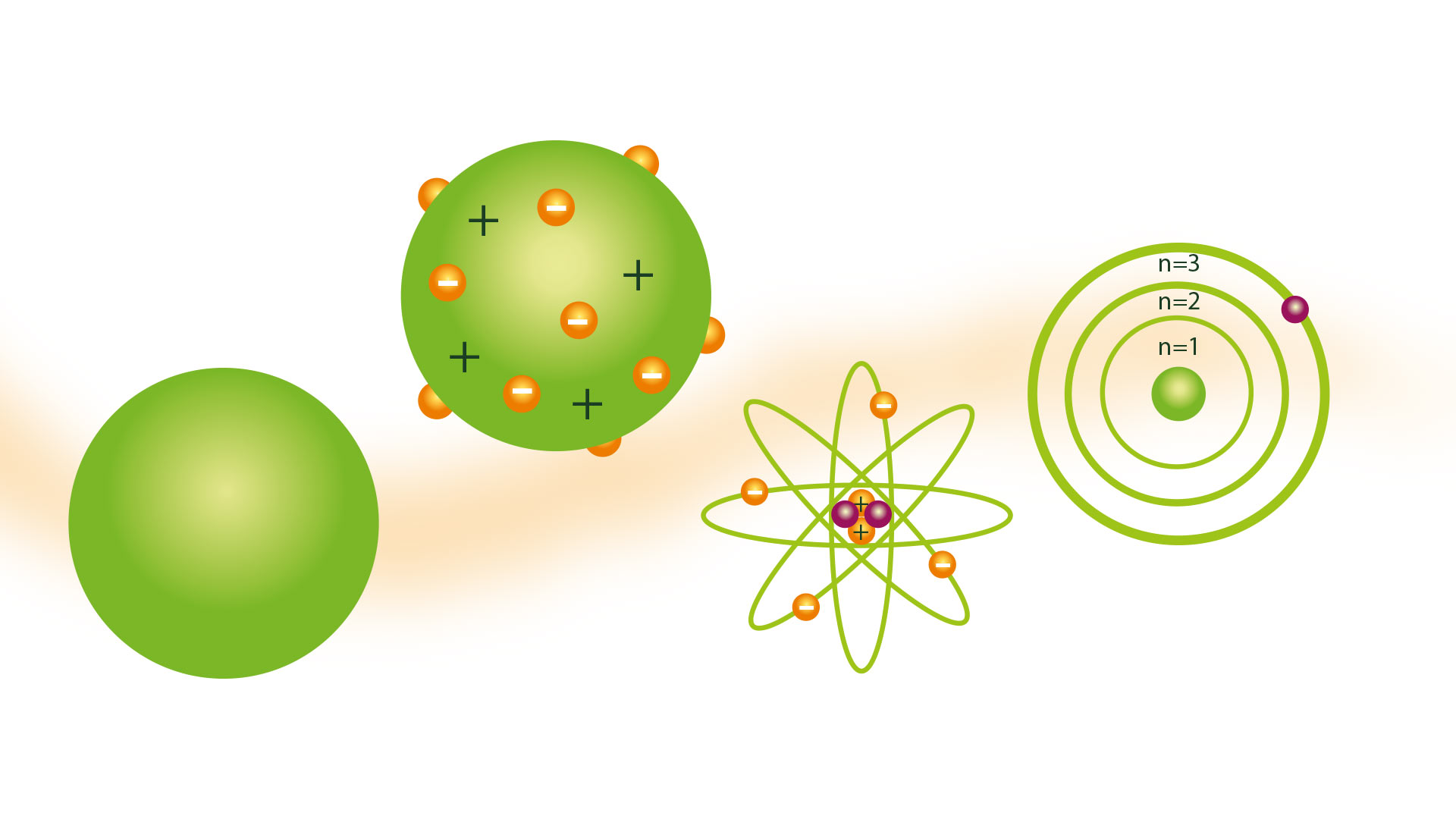
Pengertian atom seperti yang dikemukakan oleh ahli falsafah Yunani Democritus tidak dikongsi oleh ramai saintis sepanjang abad. Tetapi pada tahun 1804, the Model Atom dalton, berdasarkan teori Ahli Atom Yunani, yang diterima.

Model Atom Dalton
Selepas pemikiran atomistik dan idea-idea falsafah Yunani, kira-kira 2 ribu tahun berlalu sehingga teori atom baru diketahui kepada dunia saintifik. Asalnya adalah dalam penyiasatan John Dalton, yang merupakan ahli fizik, ahli kimia dan meteorologi British dan merupakan penganjur teori atom moden yang pertama.
Boleh dikatakan bahawa Dalton adalah apa yang dipanggil saintis lengkap, kerana kajiannya tidak terhad kepada fizik, sebaliknya, dia juga telah diiktiraf secara meluas untuk penyelidikannya tentang kemustahilan dapat menghargai warna oleh mata manusia, syarat yang, terima kasih kepadanya, hari ini ia dikenali sebagai Daltonisme.
Model atomnya dikenali sebagai model bola biliard dan telah dibentangkan pada tahun 1804. Dalton ialah seorang penyelidik saintifik dan modelnya adalah hasil yang dicapainya selepas kesimpulan yang merupakan hasil daripada pelbagai eksperimen yang dijalankannya.dengan gas. Beliau adalah pelopor teori seperti Model Atom Rutherford.
Dengan mengambil sebagai asas kesimpulan dan kesan kerjanya, Dalton dapat membuktikan bahawa atom-atom yang dibicarakan oleh orang Yunani benar-benar wujud, isu yang Teori Atom Democritus dia hanya melakar, dapat menubuhkan teori pertama berasaskan saintifik tentang kewujudan atom dalam sejarah fizik moden.
Prinsip Asas Model Atom Dalton
Model atom Dalton adalah percubaan visual pertama pada mekanisme, konformasi dan lokasi atom, yang diilhamkan antara 1803 dan 1807, John Dalton pertama kali memberikannya nama teori atom dan berdasarkannya, membuat premis berikut:
postulat pertama
Dia menentukan bahawa semua jirim terdiri daripada zarah asas, dipanggil atom, dan tidak boleh dibahagikan atau dimusnahkan. Mereka juga tidak boleh dicipta atau diubah dalam tindak balas kimia.
postulat kedua
Atom-atom yang membentuk mana-mana unsur adalah sama antara satu sama lain, bukan sahaja dalam berat, tetapi juga dalam ciri-ciri lain. Oleh itu, semua atom oksigen adalah sama. Sebaliknya, atom unsur yang berbeza berbeza antara satu sama lain mengikut beratnya. Terima kasih kepada postulat ini, pengetahuan tentang berat atom relatif timbul, melalui perbandingan atom yang berbeza dengan hidrogen, yang menurut Dalton adalah yang paling mudah.
postulat ketiga
Atom tidak boleh dibahagikan, tidak kira apa jenis tindakan kimia yang dilakukan ke atasnya. Gabungan atom yang sama atau berbeza akan menimbulkan sebatian atau bahan yang lebih kompleks, tetapi sentiasa bermula dari atom sebagai unit asas minimum jirim.
postulat keempat
Gabungan atom antara satu sama lain, untuk membentuk sebatian, akan sentiasa mendedahkan hubungan yang boleh dinyatakan dalam nombor mudah dan lengkap. Tidak pernah dalam pecahan, kerana atom tidak boleh dibahagikan. Itulah yang berlaku dengan oksigen, yang dibentuk oleh dua atom yang sama (O2), atau dengan air, yang dua sama dan satu berbeza (H2O).
postulat kelima
Dengan menggabungkan atom unsur rawak dalam jumlah yang berbeza, banyak sebatian yang berbeza boleh dibentuk. Ini adalah satu-satunya cara untuk menjelaskan bahawa, bermula dari bilangan atom yang terhad, semua jirim di alam semesta telah dibina. Sebagai contoh idea ini, atom karbon dan dua atom oksigen akan membentuk sebatian (CO2), tetapi hanya satu daripada setiap unsur akan membentuk sebatian yang berbeza (CO).
postulat keenam
Semua sebatian kimia terbentuk apabila atom dua atau lebih unsur yang berbeza dicantum, dengan cara yang tetap dan mudah. Tetapi, menurut teori Dalton, atom unsur yang sama pada mulanya tidak menunjukkan sebarang pertalian antara satu sama lain, hanya dengan kehadiran atom yang berbeza.
Undang-undang Dalton
Sebagai akibat daripada postulat ini, undang-undang berikut telah dirumuskan:
- Semua jirim terdiri daripada atom.
- Sememangnya semua yang diketahui terdiri daripada atom, baik di bumi mahupun di alam semesta yang diketahui. Setiap unsur terdiri daripada atom.
- Atom tidak boleh dibahagikan dan tidak boleh dihancurkan.
- Atom ialah zarah terkecil jirim.
- Semua atom unsur tertentu adalah sama.
- Dalam unsur tertentu, semua atomnya mempunyai jisim yang sama dan ciri-ciri yang sama.
- Atom unsur berbeza berbeza dalam jisim dan sifat.
- Setiap unsur terdiri daripada atom yang mempunyai ciri dan jisim yang berbeza.
- Sebatian terdiri daripada gabungan dua atau lebih jenis atom yang berbeza.
- Sebatian tertentu sentiasa mempunyai jenis atom yang sama digabungkan dan dalam perkadaran yang sama.
- Tindak balas kimia ialah penyusunan semula atom.
- Tindak balas kimia ialah hasil pemisahan, penyatuan atau penyusunan semula atom. Tetapi, atom satu unsur tidak pernah menjadi atom unsur lain hasil daripada tindak balas kimia.
Pertimbangan tambahan Model Atom Dalton
Seiring dengan penciptaan prinsip asas yang disenaraikan di atas, Dalton mencadangkan bahawa atom-atom dua unsur yang berkaitan antara satu sama lain untuk membentuk molekul menghormati Undang-undang Pengekalan Jisim. Ini bermakna bilangan dan jenis atom yang terdapat dalam molekul adalah sama dengan bilangan dan jenis atom unsur yang digunakan dalam tindak balas kimia.
Pernyataan lain yang relevan tentang teori ini ialah Hukum Perkadaran Berbilang, yang menurutnya apabila dua atom dua unsur digabungkan, konjugasi hanya boleh berlaku mengikut nisbah nombor bulat seperti 1:1, 2:1, 2:2. , dan sebagainya. Jika air diambil sebagai contoh, dapat dilihat bahawa H2O bergabung dalam nisbah 2:1, yang bermaksud ia mempunyai dua atom hidrogen dan satu oksigen.
Oleh itu, tidak mungkin bahagian yang berbeza daripada unsur-unsur ini boleh digunakan untuk menghasilkan air. Tidak mungkin menghasilkan air menggunakan 3 atom hidrogen dan dua atom oksigen (3:2).
Dalton juga dapat mencipta "Jadual Berat Atom" dan menggunakan data daripada jadual itu, dia dapat meletakkan unsur-unsur dalam susunan yang ditentukan oleh berat unsur-unsurnya, daripada perbandingan dengan hidrogen, yang merupakan unsur paling ringan. , yang merupakan yang pertama dalam jadual anda dan mempunyai nombor atom 1.
Model bola biliard
Akibat mempunyai idea bahawa atom adalah zarah terkecil jirim adalah untuk dapat membayangkannya sebagai sfera pepejal dan keras, yang mana banyak perwakilannya dibuat dengan model yang dibuat dengan sfera kayu, yang mana dia menerima bola biliard. nama model.
Rangkaian penaakulan teori Dalton dapat menjelaskan dengan cara yang memuaskan secara saintifik dua undang-undang: Undang-undang perkadaran malar, mengikut mana perkadaran ditetapkan antara bahan bertindak balas, dan Undang-undang perkadaran berbilang, mengikut mana perkadaran antara bahan bertindak balas. akan sentiasa melakukannya dalam nombor bulat.
Melalui perumusan ini juga mungkin untuk menjelaskan kewujudan banyak bahan asas, bermula daripada set zarah konstituen terhingga. Ia kemudiannya ditambah baik dengan teori Rutherford dan Model Atom Bohr
Model atom Dalton ialah model gabungan yang mudah, yang boleh memberikan penjelasan kepada hampir semua kimia pada zamannya dan dengannya asas untuk pembangunan dan inovasi masa depan dalam bidang kimia dan dalam pelbagai bidang sains lain.
Eksperimen Dalton
Bertentangan dengan Ahli Atom, yang hanya menggunakan logik mereka untuk mengkonseptualisasikan atom, Dalton mengasaskan pernyataannya pada sejumlah besar eksperimen yang membuktikan kewujudan atom, yang dijalankan sepenuhnya dari perspektif kimia. Beberapa yang paling terkenal ialah:
Dia menjalankan eksperimen dengan jirim dalam keadaan gas, memerhatikan kesan tekanan keadaan jirim itu, sampai pada kesimpulan bahawa atom yang terdiri daripada jirim gas berada dalam pergerakan kebetulan yang tidak terganggu.
Beberapa eksperimennya adalah berdasarkan campuran unsur-unsur untuk membuat molekul sebatian, yang keputusannya membenarkannya untuk menegaskan bahawa sebatian tertentu akan sentiasa terdiri daripada unsur-unsur yang sama dalam perkadaran yang sama dan mengikut Hukum Perkadaran Berbilangnya.
Penerimaan Model Atom Dalton
Teori atom Dalton telah diterima secara meluas oleh ramai saintis pada zamannya tanpa memerlukan banyak masa untuk itu dan menjadi asas kepada beberapa bahagian teori atom hari ini.
Walaupun para saintis hari ini juga tahu bahawa atom bukanlah zarah terkecil bahan, kerana, seperti yang diketahui, atom mengandungi beberapa jenis zarah yang lebih kecil, seperti proton, neutron dan elektron. Teori Dalton segera ditubuhkan sebagai asas teori untuk kimia.
Batasan dan Kesilapan dalam Teori Dalton
Dalton mempunyai hipotesis bahawa atom semua unsur kekal individu, kerana itu dia tidak dapat menyedari bahawa dalam beberapa unsur atom wujud dalam molekul, seperti halnya oksigen tulen yang wujud sebagai O2, iaitu, molekul unsur yang sama dengan dua atom oksigen.
Begitu juga, idea beliau bahawa sebatian paling mudah antara dua unsur sentiasa satu atom setiap satu adalah salah. Kesilapan yang menyebabkan dia membuat kesimpulan bahawa ungkapan untuk air ialah H O dan bukannya H2O.
Hakikat bahawa peralatan yang digunakan untuk melakukan eksperimennya adalah sangat asas membawa Dalton kepada beberapa kesimpulan yang salah. Pada permulaannya dia memberikan oksigen nilai 5.5, yang bermaksud bahawa ia adalah 5.5 kali lebih besar daripada atom hidrogen, yang merupakan yang dia gunakan sebagai rujukannya. Walau bagaimanapun, dia dapat membetulkan nilai tersebut beberapa tahun kemudian, memberikan oksigen nilai 7, walaupun fakta bahawa penyelidik lain pada zamannya memberikan oksigen nilai 8.
Kesan Teori Dalton
Memang benar bahawa teori atom semasa telah mencapai tahap yang tidak dapat dijelaskan beberapa tahun yang lalu, tetapi kepintaran Dalton ialah prinsip asas teorinya masih sah dalam aspek tertentu. Walau bagaimanapun, hari ini diketahui bahawa atom boleh dipisahkan melalui tindak balas di peringkat nuklear, tetapi ini tidak bermakna pernyataan Dalton bahawa mereka tidak boleh dipisahkan melalui tindak balas kimia tidak lagi sah.
Di samping itu, hari ini juga diketahui bahawa tidak semua atom daripada unsur yang sama mempunyai jisim yang sama, kerana ia adalah mungkin untuk menunjukkan bahawa isotop wujud, yang merupakan atom dengan neutron tambahan, dan bahawa mereka mempunyai jisim yang lebih besar walaupun ia sama.unsur.
Biografi Dalton
John Dalton dilahirkan di England pada 6 September 1766, keluarganya sederhana dan pendidikan awalnya adalah daripada ibu bapanya dan dari sebuah sekolah di bandarnya. Disebabkan asal usul dan keadaan ekonomi keluarganya, dia terpaksa mula bekerja pada usia 10 tahun, berkhidmat di sebuah rumah, walaupun dinyatakan bahawa dia mula mengajar di sekolah pada usia 12 tahun dan pada usia 14 tahun menjadi mahir dalam bahasa Latin.
Dalton terus mengajar dan menerima arahan tidak rasmi daripada pengajar di kawasan tempat dia tinggal, dan apabila dia mencapai umur 27 tahun dia menerima pelantikan sebagai profesor matematik dan falsafah semula jadi di sebuah universiti kecil di Manchester, jawatan di mana dia meneruskan. selama beberapa tahun.. 7 tahun, sehingga saya membuat keputusan untuk menjadi tutor swasta untuk subjek yang sama.
Sumbangan Ilmiah
Tidak dinafikan, antara sumbangannya yang paling relevan ialah teori Atomnya, tetapi John Dalton menjalankan kajian dan eksperimen tentang:
- Meteorologi.
- Pengukuran ketinggian gunung.
- Buta warna, keadaan yang kemudiannya dinamakan Daltonisme sebagai penghormatan kepadanya.
- Beberapa Undang-undang yang berkaitan dengan gas.
Dan dia membuat banyak lagi penerbitan karyanya mengenai subjek kecil, seperti yang berkaitan dengan warna langit dan juga tatabahasa Inggeris.
Dalton adalah seorang yang pendiam dan tidak pernah berkahwin. Mengabdikan dirinya secara eksklusif untuk penyelidikannya, dia menjalani kehidupan yang sederhana tanpa banyak kekecohan. Pada tahun 1837 dan 1838 dia mengalami sawan yang mengakibatkan dia menjadi bisu, tetapi itu tidak menghalangnya daripada terus menyiasat, sehingga tahun kematiannya, pada tahun 1844.