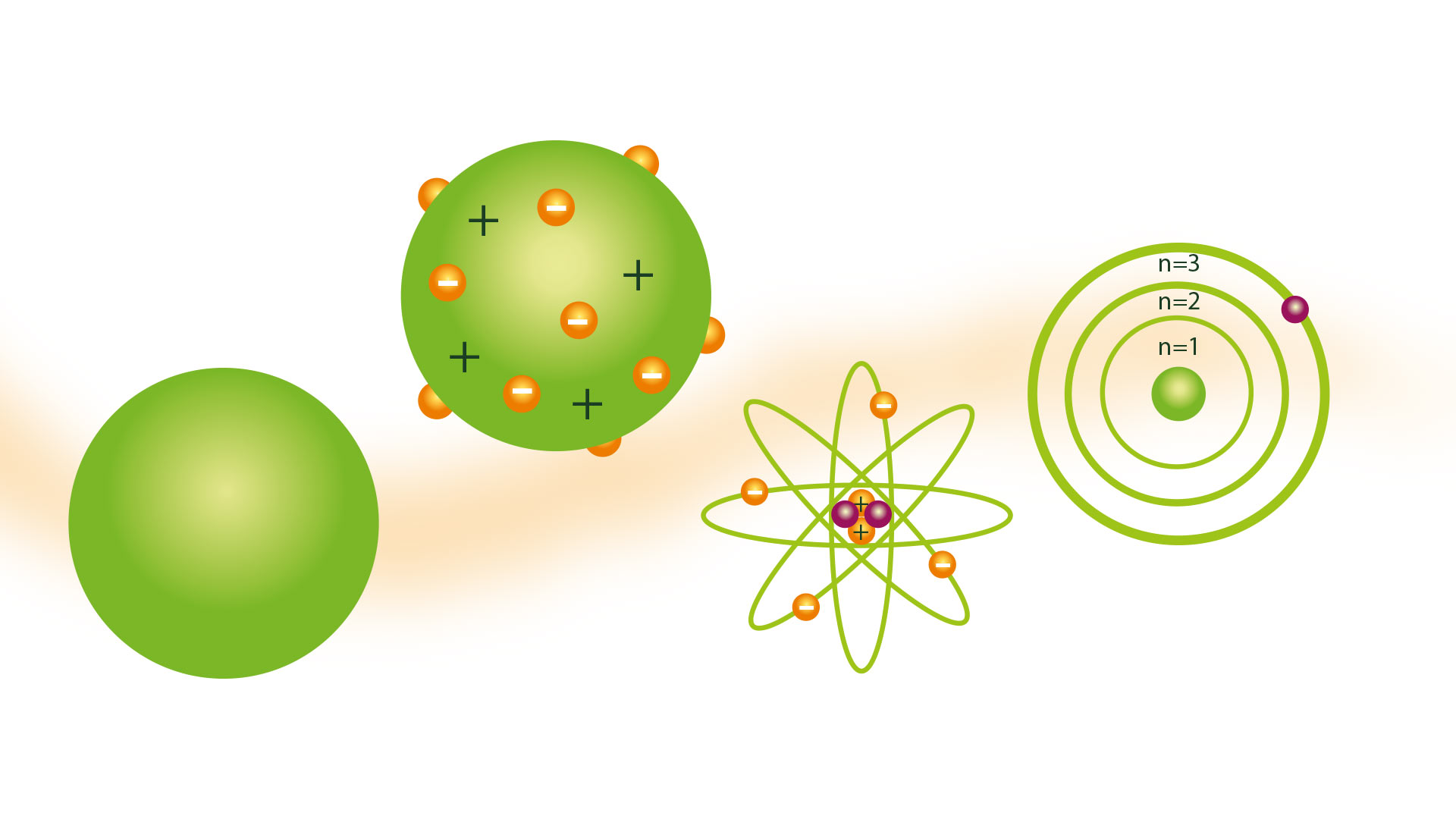
La nozione di atomo presentata dal filosofo greco Democrito non è stata condivisa da molti scienziati nel corso dei secoli. Ma nell'anno 1804, il dalton modello atomico, basato sulle teorie degli atomisti greci, che fu accettato.

Il modello atomico di Dalton
Dopo il pensiero atomistico e le idee filosofiche greche, trascorsero circa 2mila anni prima che una nuova teoria atomica fosse resa nota al mondo scientifico. La sua origine è stata nelle indagini di John Dalton, che era un fisico, chimico e meteorologo britannico e fu il promotore della prima teoria atomica moderna.
Si potrebbe dire che Dalton fosse quello che veniva definito uno scienziato completo, perché i suoi studi non si limitavano alla fisica, anzi, è stato ampiamente riconosciuto anche per le sue ricerche sull'impossibilità di poter apprezzare i colori dall'occhio umano, una condizione che, grazie a lui, oggi è conosciuta come Daltonismo.
Il suo modello atomico era conosciuto come il modello della palla da biliardo e fu presentato nel 1804. Dalton era un ricercatore scientifico e il suo modello era il prodotto a cui giungeva dopo le conclusioni che erano il risultato di molteplici esperimenti da lui effettuati con i gas. Fu il precursore di teorie come il Modello atomico di Rutherford.
Prendendo come base le conclusioni e gli effetti del suo lavoro, Dalton è stato in grado di dimostrare che gli atomi di cui parlavano i greci esistevano veramente, un problema che il Teoria atomica di Democrito aveva solo abbozzato, potendo stabilire la prima teoria scientificamente fondata dell'esistenza dell'atomo nella storia della fisica moderna.
Principi di base del modello atomico di Dalton
Il modello atomico di Dalton fu il primo tentativo visualizzato del meccanismo, della conformazione e della posizione degli atomi, concepito tra il 1803 e il 1807, John Dalton gli diede per primo il nome di teoria atomica e sulla base di esso, fece le seguenti premesse:
primo postulato
Ha stabilito che tutta la materia è composta da particelle elementari, chiamate atomi, e non possono essere né divise né distrutte. Inoltre, non potevano essere creati o modificati in una reazione chimica.
secondo postulato
Gli atomi che compongono ogni elemento sono identici tra loro, non solo nel peso, ma anche nelle altre caratteristiche. Pertanto, tutti gli atomi di ossigeno sono assolutamente uguali. Invece, atomi di elementi diversi differiscono l'uno dall'altro per il loro peso. Grazie a questo postulato nacque la conoscenza del peso atomico relativo, attraverso il confronto di atomi diversi con quello dell'idrogeno, che secondo Dalton era il più semplice.
terzo postulato
Gli atomi non possono essere divisi, indipendentemente dal tipo di azione chimica che viene eseguita su di essi. La combinazione di atomi uguali o diversi darà origine a composti o sostanze più complessi, ma sempre a partire dall'atomo come unità fondamentale minima della materia.
quarto postulato
La combinazione di atomi tra loro, per formare composti, rivelerà sempre una relazione che può essere espressa in numeri semplici e completi. Mai in frazioni, poiché gli atomi non possono essere divisi. È quello che succede con l'ossigeno, che è formato da due atomi uguali (O2), o con l'acqua, che sono due uguali e uno diverso (H2O).
quinto postulato
Combinando atomi di elementi casuali in quantità diverse, possono essere formati numerosi composti diversi. Questo è l'unico modo in cui si può spiegare che, partendo da un numero finito di atomi, tutta la materia dell'universo è stata costruita. Per esemplificare questa idea, un atomo di carbonio e due atomi di ossigeno formeranno un composto (CO2), ma solo uno di ciascun elemento formerà un composto diverso (CO).
sesto postulato
Tutti i composti chimici si formano quando gli atomi di due o più elementi diversi si uniscono, in modo costante e semplice. Ma, secondo La teoria di Dalton, gli atomi dello stesso elemento inizialmente non mostrano alcuna affinità tra loro, solo in presenza di atomi diversi.
Leggi di Dalton
In conseguenza di questi postulati, furono formulate le seguenti leggi:
- Tutta la materia è composta da atomi.
- Assolutamente tutto ciò che è noto è costituito da atomi, sia sulla terra che nell'universo conosciuto. Ciascuno degli elementi è costituito da atomi.
- Gli atomi sono indivisibili e indistruttibili.
- Gli atomi sono le particelle più piccole della materia.
- Tutti gli atomi di un dato elemento sono identici.
- In un elemento specifico, tutti i suoi atomi hanno la stessa massa e le stesse caratteristiche.
- Atomi di diversi elementi variano in massa e proprietà.
- Ogni elemento è costituito da atomi di diverse caratteristiche e massa.
- I composti sono costituiti da una combinazione di due o più tipi diversi di atomi.
- Un composto specifico ha sempre gli stessi tipi di atomi combinati e nelle stesse proporzioni.
- Una reazione chimica è un riarrangiamento di atomi.
- Le reazioni chimiche sono il prodotto di una separazione, unione o riarrangiamento di atomi. Ma gli atomi di un elemento non diventano mai atomi di un altro elemento come risultato di una reazione chimica.
Ulteriori considerazioni sul modello atomico di Dalton
Insieme alla creazione dei principi di base sopra elencati, Dalton ha proposto che gli atomi di due elementi collegati tra loro per formare molecole rispettino la legge di conservazione della massa. Ciò significa che il numero e i tipi di atomi che si trovano in una molecola sono gli stessi del numero e dei tipi di atomi degli elementi utilizzati nella reazione chimica.
Un'altra affermazione rilevante di questa teoria era la legge delle proporzioni multiple, secondo la quale quando due atomi di due elementi sono coniugati, la coniugazione può avvenire solo secondo un rapporto di numeri interi come 1:1, 2:1, 2:2 , e così via. Se si prende l'acqua come esempio, si può vedere che H2O si combina nel rapporto 2:1, il che significa che ha due atomi di idrogeno e un ossigeno.
Pertanto, non è possibile che una diversa proporzione di questi elementi possa essere utilizzata per produrre acqua. Non è possibile produrre acqua utilizzando 3 atomi di idrogeno e due atomi di ossigeno (3:2).
Dalton è stato anche in grado di creare una "Tabella dei pesi atomici" e utilizzando i dati di quella tabella, è stato in grado di posizionare gli elementi in una disposizione determinata dal peso dei loro elementi, da un confronto con l'idrogeno, che è l'elemento più leggero , che è il primo nella tua tabella e ha il numero atomico di 1.
Il modello della palla da biliardo
Una conseguenza dell'avere l'idea che gli atomi fossero le particelle più piccole della materia è stata quella di poterli immaginare come sfere solide e dure, per cui molte sue rappresentazioni sono state realizzate con modelli realizzati con sfere di legno, grazie ai quali ha ricevuto la palla da biliardo nome del modello.
La catena di ragionamenti della teoria di Dalton è stata in grado di spiegare in modo scientificamente soddisfacente due leggi: la Legge delle proporzioni costanti, secondo la quale la proporzionalità è fissata tra le sostanze reagenti, e la Legge delle proporzioni multiple, secondo la quale le proporzioni tra le sostanze reagenti lo farà sempre in numero intero.
Attraverso questa formulazione è stato anche possibile spiegare l'esistenza di numerose sostanze elementari, a partire da un insieme finito di particelle costituenti. Successivamente è stato migliorato con la teoria di Rutherford e il Modello atomico di Bohr
Il modello atomico di Dalton è un modello combinatorio essenzialmente semplice, che potrebbe fornire una delucidazione a quasi tutta la chimica del suo tempo e con essa le basi per lo sviluppo e le innovazioni future nel campo della chimica e in vari altri campi della scienza.
Gli esperimenti di Dalton
Contrariamente agli atomisti, che usavano la loro logica solo per concettualizzare l'atomo, Dalton ha basato le sue affermazioni su un gran numero di esperimenti che hanno dimostrato l'esistenza degli atomi, eseguiti interamente dal punto di vista della chimica. Molti dei più noti sono stati:
Ha effettuato esperimenti con la materia allo stato gassoso, osservando gli effetti della pressione di quello stato della materia, arrivando alla conclusione che gli atomi di cui sono composte le materie gassose sono in un movimento fortuito ininterrotto.
Alcuni dei suoi esperimenti erano basati su una miscela di elementi per formare molecole di composti, i cui risultati gli hanno permesso di affermare che un dato composto sarà sempre composto dagli stessi elementi nelle stesse proporzioni e seguendo la sua Legge delle Proporzioni Multiple.
Accettazione del modello atomico di Dalton
La teoria atomica di Dalton fu ampiamente accettata da molti scienziati del suo tempo senza che fosse richiesto molto tempo e divenne la base per alcune sezioni della teoria atomica odierna.
Sebbene oggi gli scienziati sappiano anche che gli atomi non sono le particelle più piccole della materia, poiché, come è noto, gli atomi contengono diversi tipi di particelle più piccole, come protoni, neutroni ed elettroni. La teoria di Dalton fu immediatamente stabilita come base teorica per la chimica.
Limitazioni ed errori nella teoria di Dalton
Dalton aveva ipotizzato che gli atomi di tutti gli elementi rimanessero individuali, per cui non poteva rendersi conto che in alcuni elementi gli atomi esistono nelle molecole, come nel caso dell'ossigeno puro che esiste come O2, cioè una molecola dello stesso elemento con due atomi di ossigeno.
Allo stesso modo, la sua idea che il composto più semplice tra due elementi fosse costantemente un atomo di ciascuno era sbagliata. Errore che lo ha portato a dedurre che l'espressione per acqua fosse HO invece di H2O.
Il fatto che l'attrezzatura che usava per fare i suoi esperimenti fosse molto semplice ha portato Dalton a diverse conclusioni sbagliate. All'inizio diede all'ossigeno un valore di 5.5, il che significa che era 5.5 volte più voluminoso dell'atomo di idrogeno, che era quello che usava come riferimento. Tuttavia, anni dopo riuscì a correggere quei valori, dando all'ossigeno un valore di 7, nonostante altri ricercatori del suo tempo dessero all'ossigeno un valore di 8.
Impatto della teoria di Dalton
È vero che l'attuale teoria atomica ha raggiunto livelli indescrivibili alcuni anni fa, ma il genio di Dalton è che i principi essenziali della sua teoria sono ancora validi per certi aspetti. Tuttavia, oggi è noto che gli atomi possono essere separati mediante reazioni a livello nucleare, ma ciò non significa che l'affermazione di Dalton secondo cui non possono essere separati mediante reazioni chimiche non sia più valida.
Inoltre oggi è anche noto che non tutti gli atomi di uno stesso elemento hanno la stessa massa, poiché è stato possibile dimostrare che esistono isotopi, che sono atomi con neutroni addizionali, e che hanno massa maggiore anche quando è lo stesso elemento.
La biografia di Dalton
John Dalton nacque in Inghilterra il 6 settembre 1766, la sua famiglia era umile e la sua prima educazione fu dai suoi genitori e da una scuola nella sua città. A causa delle sue origini e della condizione economica della sua famiglia, dovette iniziare a lavorare all'età di 10 anni, prestando servizio in una casa, anche se si dice anche che iniziò ad insegnare in una scuola all'età di 12 anni e che a 14 divenne esperto in latino.
Dalton ha continuato a insegnare e a ricevere istruzioni informali da istruttori della zona in cui viveva, e quando ha raggiunto l'età di 27 anni ha ricevuto l'incarico di professore di matematica e filosofia naturale in una piccola università di Manchester, posizione in cui ha continuato per diversi anni 7 anni, fino a quando non prendo la decisione di diventare un tutor privato per quelle stesse materie.
Contributi scientifici
Indubbiamente, tra i suoi contributi più rilevanti c'è la sua teoria dell'atomo, ma John Dalton ha condotto studi ed esperimenti su:
- Meteorologia.
- Misurazioni delle altezze delle montagne.
- Daltonismo, una condizione che in seguito fu chiamata daltonismo in suo onore.
- Alcune leggi relative ai gas.
E fece molte altre pubblicazioni delle sue opere su argomenti minori, come quella relativa al colore del cielo e anche sulla grammatica inglese.
Dalton era un uomo di carattere riservato e mai sposato. Dedicandosi esclusivamente alla sua ricerca, condusse una vita modesta senza troppe storie. Negli anni 1837 e 1838 soffrì di convulsioni che lo portarono a diventare muto, ma che non gli impedirono di continuare a indagare, fino all'anno della sua morte, nel 1844.