La gran historia de cómo Dmitry Ivanovich Mendeleev publicó la primera versión de la tabla que explica todo lo que existe.
Cada año, millones de estudiantes de secundaria en todo el mundo se encuentran frente a una mesa colorida, llena de letras y números, que de alguna manera cuenta todo el universo. Este testimonio de quiénes somos y de qué está hecho todo es la tabla periódica de los elementos, que en 2019 cumplió 150 años.
Fue el químico ruso Dmitrij Ivanovich Mendeleev quien encontró la manera de ordenar el oxígeno, el carbono, el hierro y todos los demás elementos descubiertos -y aún por descubrir- en una tabla para poder clasificarlos. Su intuición se hizo pública por primera vez el 6 de marzo de 1869, pero la historia de la tabla periódica comenzó mucho antes y dice mucho sobre cómo funciona la investigación científica: la forma en que tratamos de entender el mundo.
La lista de Lavoisier
La mayoría de los historiadores de la ciencia remontan los orígenes de la tabla periódica a los estudios realizados por el químico francés Antoine-Laurent de Lavoisier, a finales del siglo XVIII. Antes de encontrar un final muy malo, condenado a muerte por decapitación por el tribunal revolucionario francés, Lavoisier fue responsable de algunos de los avances más importantes en la investigación científica de su tiempo. Junto con su esposa Marie-Anne, dedicó muchos años al estudio de los elementos: sustancias como el oxígeno y el carbono que no pueden «descomponerse» por reacción química en otras sustancias. Lavoisier también enunció la primera versión de la ley de conservación de la masa, después de haber entendido que en una reacción química la suma de los pesos de las sustancias iniciales debe ser igual a la de las sustancias obtenidas después de la reacción.
En 1789, Lavoisier publicó una lista inicial de los 33 elementos identificados hasta ese momento, sabiendo que probablemente quedaban muchos más por descubrir (su lista mostraba alrededor de una quinta parte de los que se conocen hoy). El oro, el hierro y el azufre se conocen desde la antigüedad, mientras que otros se han descubierto más recientemente. Aunque incompleta, la lista fue el primer intento de poner los elementos en orden, un rompecabezas muy complicado que llevaría más de un siglo resolver y muchas décadas más para completar con casi todas sus piezas.

Proust y Dalton
Cinco años después de la publicación de su lista, Lavoisier fue condenado a muerte por el tribunal popular revolucionario y fue decapitado. Era 1794, el mismo año en que otro científico, Louis-Joseph Proust, había llegado a la conclusión de que si la ley de conservación de Lavoisier era válida, entonces había que añadir una nueva pieza relacionada con las «proporciones definidas». Proust enunció su nueva ley en 1799: cuando dos o más elementos reaccionan entre sí formando un compuesto, siempre se componen según proporciones de masa definidas y constantes.
Aunque su ley sugería que los compuestos químicos debían estar hechos de partículas de diferentes pesos, cada una atribuible a un elemento dado. Fue el científico británico John Dalton (a quien debemos el término «daltonismo»: que no podía ver algunos colores y fue uno de los principales estudiosos de esta condición) quien demostró a principios del siglo XIX que cuando dos elementos se combinan para formar compuestos, una cantidad de un elemento se combina con cantidades que son múltiplos del otro, que se relacionan entre sí como pequeños números enteros.
Básicamente, si combino 12 gramos de carbono con 16 gramos de oxígeno, obtengo monóxido de carbono (CO), pero si combino los primeros con el doble de oxígeno, obtengo dióxido de carbono (CO2). Con la misma masa de carbono, el dióxido de carbono contiene el doble de oxígeno que el monóxido de carbono. De ello se deduce que el valor de la relación de combinación es la mitad.
«Cosas» diminutas al ojo humano, los átomos
Para explicar su ley, Dalton asumió que cada elemento estaba compuesto de diminutas cosas invisibles al ojo humano, todas con el mismo peso. Los llamó «átomos», retomando la palabra griega utilizada para definir algo indivisible.

Poniendo orden
En pocos años Lavoisier, Proust y Dalton habían formalizado las tres leyes clásicas de la química (leyes del peso), demostrando el potencial del método científico y los rápidos avances en una disciplina fundamental para entender cómo funciona el mundo, pero era necesario poner orden entre tantas novedades.
Entre los primeros en hacer esto estuvo el químico sueco Jöns Jacob Berzelius, quien introdujo abreviaturas para los elementos, usando una o dos letras como «C» para el carbono y «Fe» para el hierro. A las abreviaturas añadió números para indicar las proporciones de los diversos elementos: como el «2» en H2O, que indica las dos partes de hidrógeno unidas a una de oxígeno para formar la molécula de agua. Esas letras y números habrían terminado en la tabla periódica de elementos y siguen siendo esenciales hoy en día.
Berzelius era un tipo bastante creativo e inquisitivo. Después de conocer la pila eléctrica inventada por el italiano Alessandro Volta, y que producía electricidad a través de una reacción química, comenzó a experimentar para intentar obtener el efecto contrario. Usó la electricidad de la batería para inducir reacciones químicas en soluciones, llamadas electrólisis.
Esta técnica, adoptada por varios otros científicos, demostró ser fundamental para descubrir una amplia variedad de elementos químicos previamente desconocidos. En pocos años se identificaron elementos cuya existencia ahora parece haberse dado siempre por sentada, como el sodio, el magnesio, el potasio y el calcio. Se agregaron docenas de nuevos elementos a la treintena enumerada por Lavoisier, lo que generó nuevas preguntas: ¿cuántos elementos hay realmente en la naturaleza? ¿Cómo podemos descubrir a los demás? ¿Existen sustancias que pensamos que son el resultado de la unión de otros elementos y que en cambio son elementos en sí mismos?

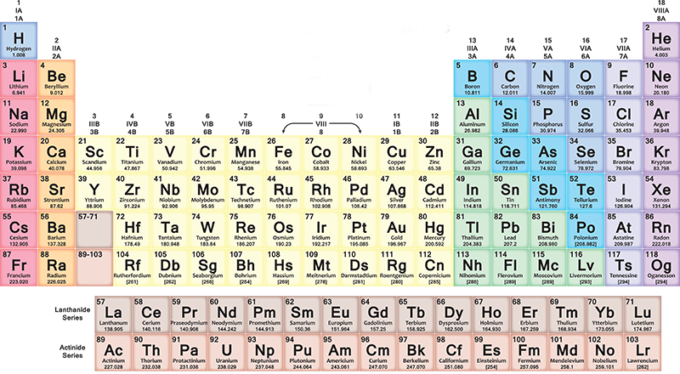
La tabla periódica
A medida que continuaba la carrera por los elementos, muchos científicos comenzaron a preguntarse cómo ordenar y dar sentido a sus nuevos descubrimientos. Para ello, había que examinar las sustancias individuales y comparar sus características en busca de cosas en común. Se descubrió que algunos elementos podían agruparse en tríos y clasificarse por peso atómico: el elemento del centro siempre tenía un peso igual al peso medio entre sus dos compañeros más ligeros y más pesados.
A principios de la década de 1860, los químicos tenían a su disposición tres leyes fundamentales, docenas de elementos, el conocimiento de alguna característica recurrente entre ellos, pero ningún sistema de catalogación para orientarse en el mundo que habían descubierto. Poner la química en orden se convirtió casi en una obsesión para un profesor de química de la Universidad de San Petersburgo en Rusia: Dmitry Ivanovich Mendeleev. A fines de febrero y principios de marzo de 1869, Mendeleev trabajó para dar sentido a los elementos. Fue literalmente un compromiso continuo: trabajó día y noche, perdiendo finalmente la noción del tiempo y llegando a decir, más tarde, que la idea definitiva para resolver el rompecabezas de la química se le había ocurrido después de un breve sueño.
Creación de la tabla periódica
Mendeleev creó una tabla en la que se enumeraban los elementos según un criterio preciso, que tenía en cuenta las relaciones entre sus características. Su sistema fue mejor que otros intentos anteriores por una sencilla razón: era más honesto. Es decir, contemplaba la posibilidad de que hubiera otros elementos por descubrir y que, por tanto, era normal que algunas casillas del esquema estuvieran vacías. Mendeleev atrajo muchas críticas por haber dejado esos agujeros, pero los descubrimientos de las décadas siguientes le darían la razón.
La mesa no solo contemplaba la posibilidad de que se descubrieran nuevos elementos: también cuestionaba si algunas de las mediciones realizadas hasta entonces sobre algunos de ellos eran precisas. En la tabla, Mendeleev invirtió algunos elementos que sustentan esta teoría. En algunos casos, mediciones más precisas le dieron la razón, en otros casos no, demostrando que a los científicos de la época todavía les faltaba algo sobre el peso atómico.

La evolución de la tabla de Mendeleev
La belleza de la tabla periódica de elementos, posiblemente la cuadrícula favorita de los químicos, es que no parece un patrón uniforme. Algunas filas tienen un puñado de elementos, mientras que otras se completan con 18 elementos. Se llama «periódico» porque Mendeleev explotó la recurrencia de las propiedades químicas, agrupando elementos con características químicas similares.
Con el descubrimiento de nuevos elementos en los años siguientes, incluido el sorprendente para la época de los gases nobles (como el helio), inertes y, por lo tanto, difíciles de detectar, la tabla de Mendeleev demostró ser un punto de partida formidable para refinar un esquema que lo abarca todo de los elementos, a pesar de las complicaciones que traen nuevas intuiciones y evidencias científicas. A finales del siglo XIX, por ejemplo, se descubrió que los átomos podían perder piezas, lo que sugería que ellos mismos estaban formados por partes más pequeñas y aún no observadas.
Estructura química
Una vez más, en unas pocas décadas, la química dio pasos agigantados que condujeron a la formulación de teorías sobre la estructura atómica. Descubrieron cosas que hoy en día damos por sentadas, como la existencia de protones (con carga positiva), neutrones (sin carga) y electrones (con carga negativa), es decir, los componentes subatómicos. Esto condujo a la determinación del número atómico, que indica el número de protones contenidos en un núcleo atómico.
Sin embargo, al no tener conocimiento disponible en 1869, Mendeleev había ordenado su esquema sobre el peso atómico (aunque con alguna sustitución en el orden de los elementos para que el diseño general encajara). Sin querer, Mendeleev había ordenado los elementos en orden de número atómico, años antes de que se introdujera este mismo concepto. La sustitución de los números atómicos en los valores de la tabla dio lugar a la secuencia definitiva de la tabla periódica que conocemos hoy. Además del descubrimiento de la estructura del átomo, en el siglo XX la mecánica cuántica habría dado lugar a mayores evoluciones y refinamientos de la tabla periódica, que se reflejan en el modelo actual de 18 columnas.
Cómo se hace y lee la tabla periódica
En la tabla periódica, los elementos se insertan progresivamente en cada fila (período) de izquierda a derecha según la secuencia de sus números atómicos: cada nueva fila comienza después de un gas noble. El primer elemento de la fila siempre es un metal alcalino, con un número atómico uno mayor que el elemento con el que terminó la fila anterior. Más generalmente, en las siete filas de la tabla, los metales están a la izquierda y otros tipos de elementos a la derecha.
Así que a medida que avanzas hacia la derecha encontrarás elementos cada vez más pesados, con diferentes características desde metal hasta gas. Cuando llegas al final de una fila y empiezas la siguiente, siempre de izquierda a derecha, la distribución se repite cíclicamente. Todo vuelve con una cierta armonía, que te dejará sorprendido si intentas leer la tabla fijándote en ella.
Las columnas (grupos o familias) contienen elementos con características químicas similares. Por ejemplo, tienen la misma configuración electrónica externa, es decir, electrones que se comportan de la misma manera alrededor del núcleo de sus átomos. Hay 18 grupos y van desde el grupo de los metales alcalinos hasta el de los gases nobles.
No todos los elementos son naturales
Los elementos con números atómicos del 1 al 118 ocupan las siete filas de la tabla periódica: los primeros 94 son todos naturales, mientras que los del 95 al 118 se han obtenido artificialmente. Las investigaciones para desarrollar nuevos elementos aún están en progreso, así como también hay algunos problemas por resolver en la organización actual del esquema.
A pesar de algunos ajustes, en general en sus 150 años de existencia, la tabla periódica de elementos ha demostrado ser esencial no solo para ordenar los elementos que lo componen todo, incluidos los ojos que usa para leer estas palabras, sino también para analizar la química de las reacciones, descubrir relaciones entre diferentes compuestos y estudiar física nuclear. Las filas y columnas del cuadro son una síntesis incomparable de lo que fue la investigación científica que hizo posible su creación y, en cierto sentido, de lo que será.