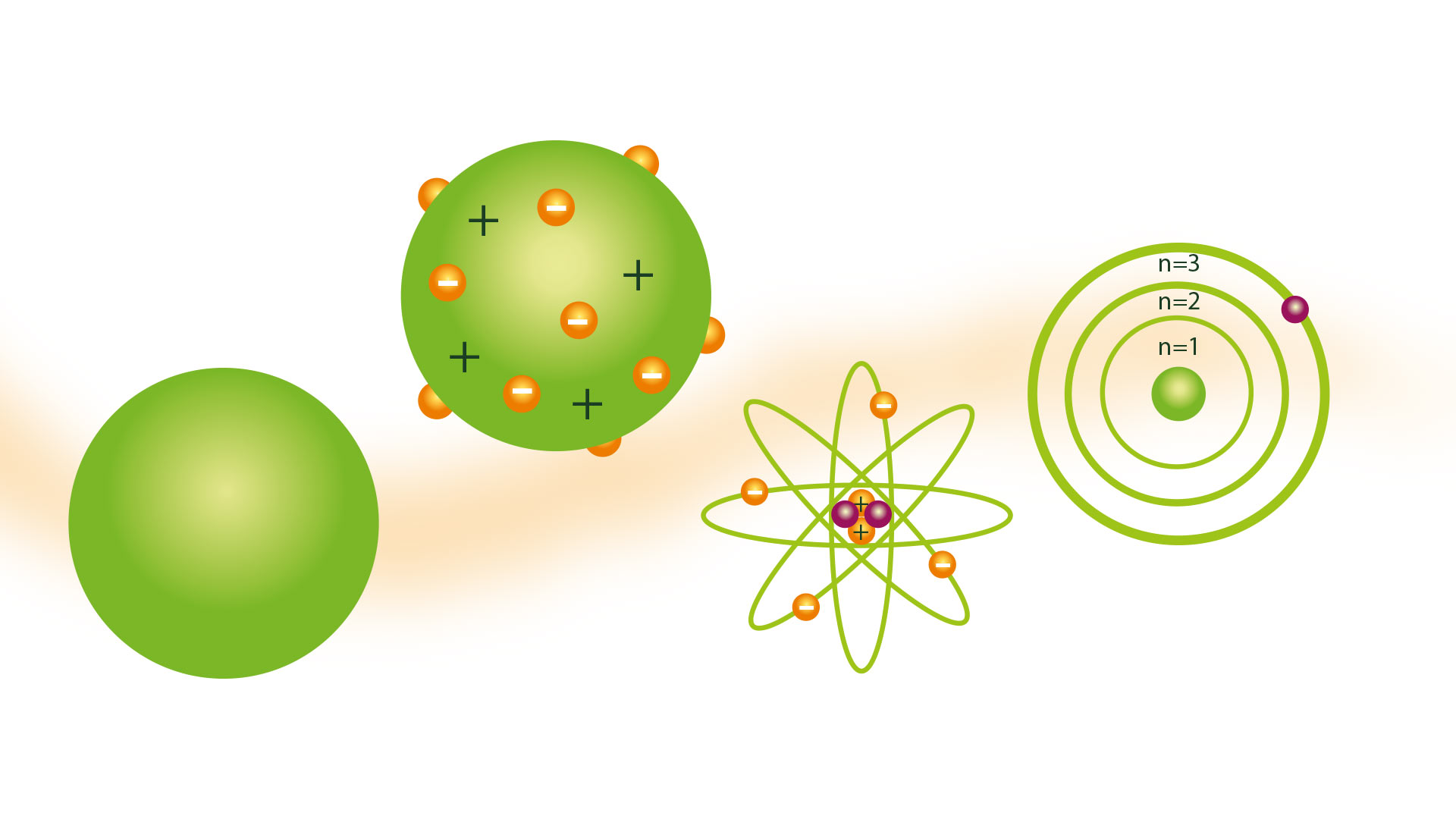
Forestillingen om atomet som præsenteret af den græske filosof Demokrit blev ikke delt af mange videnskabsmænd gennem århundrederne. Men i året 1804 blev den dalton atommodel, baseret på de græske atomisters teorier, som blev accepteret.

Daltons atommodel
Efter den atomistiske tanke og de græske filosofiske ideer gik der omkring 2 tusinde år, indtil en ny atomteori blev gjort kendt for den videnskabelige verden. Dens oprindelse var i John Daltons forskning, som var en britisk fysiker, kemiker og meteorolog og var promotoren af den første moderne atomteori.
Man kunne sige, at Dalton var det, man kaldte en komplet videnskabsmand, fordi hans studier ikke var begrænset til fysik, tværtimod, han er også blevet bredt anerkendt for sin forskning om umuligheden af at kunne værdsætte farver med det menneskelige øje, en tilstand, der takket være ham i dag er kendt som daltonisme.
Hans atommodel var kendt som billardkuglemodellen og blev præsenteret i 1804. Dalton var en videnskabelig forsker, og hans model var det produkt, han nåede frem til efter de konklusioner, som var resultatet af flere eksperimenter, han udførte med gasser. Han var forløberen for teorier som f.eks Rutherford atommodel.
Med udgangspunkt i konklusionerne og virkningerne af sit arbejde var Dalton i stand til at bevise, at de atomer, som grækerne talte om, virkelig eksisterede, et problem, som Demokrits atomteori han havde kun skitseret, idet han var i stand til at etablere den første videnskabeligt baserede teori om atomets eksistens i den moderne fysiks historie.
Grundlæggende principper for Daltons atommodel
Daltons atommodel var det første visualiserede forsøg på atomers mekanisme, konformation og placering, udtænkt mellem 1803 og 1807, John Dalton gav den først navnet atomteori og ud fra den lavede han følgende præmisser:
første postulat
Han fastslog, at alt stof består af elementarpartikler, kaldet atomer, og kan hverken opdeles eller ødelægges. De kunne heller ikke skabes eller ændres i en kemisk reaktion.
andet postulat
De atomer, der udgør ethvert element, er identiske med hinanden, ikke kun i vægt, men også i andre egenskaber. Derfor er alle iltatomer absolut ens. I stedet adskiller atomer af forskellige grundstoffer sig fra hinanden ved deres vægt. Takket være dette postulat opstod kendskabet til den relative atomvægt, gennem sammenligning af forskellige atomer med brint, som ifølge Dalton var det enkleste.
tredje postulat
Atomer kan ikke opdeles, uanset hvilken type kemisk virkning der udføres på dem. Kombinationen af de samme eller forskellige atomer vil give anledning til mere komplekse forbindelser eller stoffer, men altid med udgangspunkt i atomet som den minimale grundlæggende enhed af stof.
fjerde postulat
Kombinationen af atomer med hinanden, for at danne forbindelser, vil altid afsløre et forhold, der kan udtrykkes i simple og fuldstændige tal. Aldrig i brøker, da atomer ikke kan opdeles. Det er, hvad der sker med ilt, som er dannet af to lige store atomer (O2), eller med vand, som er to lige store og et forskelligt (H2O).
femte postulat
Ved at kombinere atomer af tilfældige grundstoffer i forskellige mængder kan der dannes adskillige forskellige forbindelser. Dette er den eneste måde, hvorpå det kan forklares, at alt stoffet i universet er blevet bygget ud fra et begrænset antal atomer. For at eksemplificere denne idé vil et carbonatom og to oxygenatomer danne en forbindelse (CO2), men kun et af hvert grundstof vil danne en anden forbindelse (CO).
sjette postulat
Alle kemiske forbindelser dannes, når to eller flere forskellige grundstoffers atomer forbindes på en konstant og enkel måde. Men ifølge Daltons teori, atomer af det samme grundstof udviser i begyndelsen ikke nogen affinitet for hinanden, kun i nærværelse af forskellige atomer.
Daltons love
Som en konsekvens af disse postulater blev følgende love formuleret:
- Alt stof består af atomer.
- Absolut alt, hvad der er kendt, består af atomer, både på jorden og i det kendte univers. Hvert af grundstofferne er opbygget af atomer.
- Atomer er udelelige og uforgængelige.
- Atomer er de mindste partikler af stof.
- Alle atomer i et givet grundstof er identiske.
- I et bestemt grundstof har alle dets atomer den samme masse og de samme egenskaber.
- Atomer af forskellige grundstoffer varierer i masse og egenskaber.
- Hvert grundstof er opbygget af atomer med forskellige egenskaber og masse.
- Forbindelser er opbygget af en kombination af to eller flere forskellige slags atomer.
- En specifik forbindelse har altid de samme slags atomer kombineret og i de samme proportioner.
- En kemisk reaktion er en omlejring af atomer.
- Kemiske reaktioner er produktet af en adskillelse, forening eller omlejring af atomer. Men atomer af et grundstof bliver aldrig atomer af et andet grundstof som følge af en kemisk reaktion.
Yderligere overvejelser om Dalton-atommodellen
Sammen med skabelsen af de grundlæggende principper, der er anført ovenfor, foreslog Dalton, at atomerne af to elementer, der er relateret til hinanden for at danne molekyler, respekterer loven om bevarelse af masse. Det betyder, at antallet og typer af atomer, der findes i et molekyle, er det samme som antallet og typer af atomer af de grundstoffer, der bruges i den kemiske reaktion.
En anden relevant udsagn af denne teori var loven om multiple proportioner, ifølge hvilken når to atomer af to elementer er konjugeret, kan konjugationen kun forekomme i forhold til hele tal såsom 1:1, 2:1, 2:2 , og så videre. Tages vand som eksempel, kan det ses, at H2O kombineres i forholdet 2:1, hvilket betyder, at det har to brintatomer og et oxygen.
Derfor er det ikke muligt, at en anden andel af disse elementer kan bruges til at producere vand. Det er ikke muligt at producere vand ved at bruge 3 brintatomer og to oxygenatomer (3:2).
Dalton var også i stand til at skabe en "Tabel over Atomic Weights", og ved hjælp af dataene fra den tabel var han i stand til at placere grundstofferne i et arrangement bestemt af vægten af deres grundstoffer ud fra en sammenligning med brint, som er det letteste grundstof. , som er den første i din tabel og har atomnummeret 1.
Billardboldmodellen
En konsekvens af at have ideen om, at atomer var de mindste partikler af stof, var at kunne forestille sig dem som faste og hårde kugler, hvortil mange af hans fremstillinger blev lavet med modeller lavet med trækugler, takket være hvilke han modtog billardkuglen modelnavn.
Begrundelseskæden i Daltons teori var i stand til på en videnskabeligt tilfredsstillende måde at forklare to love: loven om konstante proportioner, ifølge hvilken proportionalitet er fastsat mellem reagerende stoffer, og loven om multiple proportioner, ifølge hvilken proportionerne mellem reagerende stoffer vil altid gøre det i hele tal.
Gennem denne formulering var det også muligt at forklare eksistensen af adskillige elementære stoffer, startende fra et begrænset sæt af partikler. Det blev senere forbedret med Rutherfords teori og Bohr Atomic Model
Daltons atommodel er en i det væsentlige simpel kombinatorisk model, som kunne give en belysning af næsten al sin tids kemi og dermed grundlaget for udviklingen og fremtidige innovationer inden for kemiområdet og på forskellige andre videnskabsområder.
Daltons eksperimenter
I modsætning til atomisterne, som kun brugte deres logik til at begrebsliggøre atomet, baserede Dalton sine påstande på et stort antal eksperimenter, der beviste eksistensen af atomer, udført udelukkende ud fra et kemiperspektiv. Flere af de mest kendte var:
Han udførte eksperimenter med stof i en gasformig tilstand, idet han observerede virkningerne af trykket af denne stoftilstand, og nåede frem til den konklusion, at atomerne, som gasformige stoffer er sammensat af, er i en uafbrudt tilfældig bevægelse.
Nogle af hans eksperimenter var baseret på en blanding af grundstoffer til at lave molekyler af forbindelser, hvis resultater gjorde det muligt for ham at hævde, at en given forbindelse altid vil bestå af de samme grundstoffer i samme proportioner og i overensstemmelse med hans lov om flere proportioner.
Accept af Dalton Atomic Model
Daltons atomteori blev bredt accepteret af mange videnskabsmænd på hans tid, uden at der krævedes meget tid til den og blev grundlaget for nogle dele af nutidens atomteori.
Selvom forskerne i dag også ved, at atomer ikke er de mindste partikler af stof, da atomer som bekendt indeholder flere slags mindre partikler, såsom protoner, neutroner og elektroner. Daltons teori blev straks etableret som det teoretiske grundlag for kemi.
Begrænsninger og fejl i Daltons teori
Dalton havde den hypotese, at alle grundstoffernes atomer forblev individuelle, hvorfor han ikke var i stand til at indse, at i nogle grundstoffer eksisterer atomerne i molekyler, som det er tilfældet med ren oxygen, der eksisterer som O2, dvs. et molekyle af samme grundstof med to iltatomer.
Ligeledes var hans idé om, at den enkleste forbindelse mellem to grundstoffer konstant er et atom af hvert forkert. Fejl, der fik ham til at udlede, at udtrykket for vand var HO i stedet for H2O.
Det faktum, at det udstyr, han brugte til at lave sine eksperimenter, var meget grundlæggende, førte Dalton til flere forkerte konklusioner. I sin begyndelse gav han oxygen en værdi på 5.5, hvilket betyder, at det var 5.5 gange mere voluminøst end brintatomet, som var det, han brugte som sin reference. Han var dog i stand til at korrigere disse værdier år senere, hvilket gav oxygen en værdi på 7, på trods af at andre forskere på hans tid gav oxygen en værdi på 8.
Virkningen af Daltons teori
Det er rigtigt, at den nuværende atomteori har nået niveauer, der var ubeskrivelige for et par år siden, men Daltons genialitet er, at de væsentlige principper i hans teori stadig er gyldige i visse henseender. Men i dag ved man, at atomer kan adskilles ved hjælp af reaktioner på kerneniveau, men det betyder ikke, at Daltons udsagn om, at de ikke kan adskilles ved hjælp af kemiske reaktioner, ikke længere er gyldig.
Derudover ved man i dag også, at ikke alle atomer af samme grundstof har samme masse, da det har været muligt at påvise, at der findes isotoper, som er atomer med yderligere neutroner, og at de har en større masse, selv når det er samme element.
Daltons biografi
John Dalton blev født i England den 6. september 1766, hans familie var ydmyg og hans tidlige uddannelse kom fra hans forældre og fra en skole i hans by. På grund af sin oprindelse og sin families økonomiske tilstand måtte han som 10-årig begynde at arbejde og tjene i et hus, selvom det også oplyses, at han begyndte at undervise på en skole som 12-årig, og at han som 14-årig blev dygtig til latin.
Dalton fortsatte med at undervise og modtage uformel undervisning fra instruktører i det område, hvor han boede, og da han nåede en alder af 27, fik han en udnævnelse som professor i matematik og naturfilosofi ved et lille universitet i Manchester, en stilling, hvor han fortsatte. i flere år 7 år, indtil jeg træffer beslutningen om at blive privatlærer i de samme fag.
Videnskabelige bidrag
Uden tvivl er blandt hans mest relevante bidrag hans teori om atomet, men John Dalton udførte undersøgelser og eksperimenter om:
- Meteorologi.
- Målinger af bjergenes højder.
- Farveblindhed, en tilstand, der senere blev kaldt daltonisme til hans ære.
- Nogle love relateret til gasser.
Og han lavede mange andre udgivelser af sine værker om mindre emner, såsom den, der var relateret til himlens farve og endda om engelsk grammatik.
Dalton var en reserveret mand og giftede sig aldrig. Han helligede sig udelukkende sin forskning og førte et beskedent liv uden megen ballade. I årene 1837 og 1838 led han af anfald, der resulterede i, at han blev stum, men det forhindrede ham ikke i at fortsætte med at undersøge, indtil hans dødsår, i 1844.