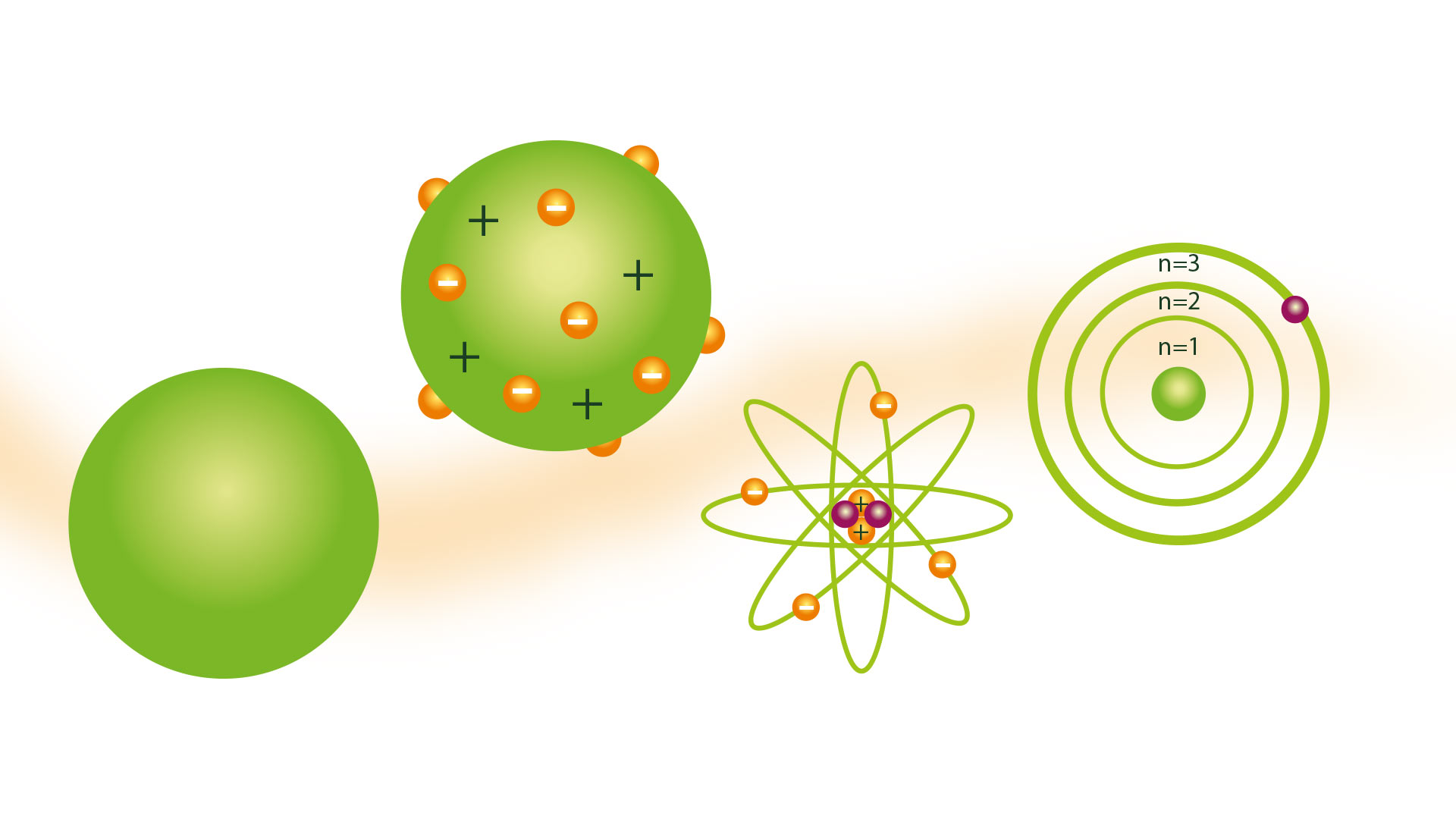
Pojem atomu, jak jej prezentoval řecký filozof Democritus, mnoho vědců po staletí nesdílelo. Ale v roce 1804, atomový model dalton, na základě teorií řeckých atomistů, což bylo přijato.

Daltonův atomový model
Po atomistické myšlence a řeckých filozofických myšlenkách uplynulo asi 2 tisíce let, než byla vědeckému světu dána na vědomí nová atomová teorie. Jeho původ byl ve výzkumu Johna Daltona, který byl britským fyzikem, chemikem a meteorologem a byl propagátorem první moderní atomové teorie.
Dalo by se říci, že Dalton byl tím, kdo byl nazýván úplným vědcem, protože jeho studium se neomezovalo pouze na fyziku, naopak, byl také široce uznáván pro svůj výzkum o nemožnosti ocenit barvy lidským okem, stav, který je díky němu dnes znám jako daltonismus.
Jeho atomový model byl známý jako model kulečníkové koule a byl představen v roce 1804. Dalton byl vědeckým výzkumníkem a jeho model byl produktem, ke kterému dospěl po závěrech, které byly výsledkem mnoha experimentů, které provedl s plyny. Byl předchůdcem teorií jako např Rutherfordův atomový model.
Na základě závěrů a účinků své práce byl Dalton schopen dokázat, že atomy, o kterých Řekové mluvili, skutečně existují, což je problém, který Demokritova atomová teorie pouze načrtl a byl schopen založit první vědecky podloženou teorii existence atomu v dějinách moderní fyziky.
Základní principy Daltonova atomového modelu
Daltonův atomový model byl prvním vizualizovaným pokusem o mechanismus, konformaci a umístění atomů, vznikl v letech 1803 až 1807, John Dalton mu poprvé dal jméno atomová teorie a na jeho základě vytvořil následující premisy:
první postulát
Zjistil, že veškerá hmota se skládá z elementárních částic, zvaných atomy, a nelze je ani rozdělit, ani zničit. Také nemohly být vytvořeny nebo změněny v chemické reakci.
druhý postulát
Atomy, které tvoří jakýkoli prvek, jsou navzájem totožné, a to nejen hmotností, ale i jinými vlastnostmi. Proto jsou všechny atomy kyslíku naprosto stejné. Místo toho se atomy různých prvků od sebe liší svou hmotností. Díky tomuto postulátu vznikla znalost relativní atomové hmotnosti, a to srovnáním různých atomů s vodíkem, což bylo podle Daltona nejjednodušší.
třetí postulát
Atomy nelze dělit, bez ohledu na to, jaký typ chemického působení na ně probíhá. Kombinace stejných nebo různých atomů dá vzniknout složitějším sloučeninám nebo látkám, ale vždy počínaje atomem jako minimální základní jednotkou hmoty.
čtvrtý postulát
Kombinace atomů mezi sebou za účelem vytvoření sloučenin vždy odhalí vztah, který lze vyjádřit jednoduchými a úplnými čísly. Nikdy ve zlomcích, protože atomy nelze dělit. To se děje s kyslíkem, který je tvořen dvěma stejnými atomy (O2), nebo s vodou, které jsou dva stejné a jeden různý (H2O).
pátý postulát
Kombinací atomů náhodných prvků v různých množstvích lze vytvořit mnoho různých sloučenin. To je jediný způsob, jak lze vysvětlit, že z konečného počtu atomů byla vytvořena veškerá hmota ve vesmíru. Pro ilustraci této myšlenky, atom uhlíku a dva atomy kyslíku vytvoří sloučeninu (CO2), ale pouze jeden z každého prvku vytvoří jinou sloučeninu (CO).
šestý postulát
Všechny chemické sloučeniny vznikají spojením atomů dvou nebo více různých prvků konstantním a jednoduchým způsobem. Ale podle Daltonova teorieatomy stejného prvku k sobě zpočátku nevykazují žádnou afinitu, pouze v přítomnosti různých atomů.
Daltonovy zákony
V důsledku těchto postulátů byly formulovány následující zákony:
- Veškerá hmota se skládá z atomů.
- Naprosto vše, co je známo, se skládá z atomů, jak na Zemi, tak ve známém vesmíru. Každý z prvků se skládá z atomů.
- Atomy jsou nedělitelné a nezničitelné.
- Atomy jsou nejmenší částice hmoty.
- Všechny atomy daného prvku jsou totožné.
- V konkrétním prvku mají všechny jeho atomy stejnou hmotnost a stejné vlastnosti.
- Atomy různých prvků se liší hmotností a vlastnostmi.
- Každý prvek se skládá z atomů různých vlastností a hmotnosti.
- Sloučeniny jsou tvořeny kombinací dvou nebo více různých druhů atomů.
- Konkrétní sloučenina má vždy stejné druhy atomů kombinované a ve stejných poměrech.
- Chemická reakce je přeskupení atomů.
- Chemické reakce jsou produktem separace, spojení nebo přeskupení atomů. Atomy jednoho prvku se však nikdy nestanou atomy jiného prvku v důsledku chemické reakce.
Další úvahy o daltonském atomovém modelu
Spolu s vytvořením základních principů uvedených výše Dalton navrhl, aby atomy dvou prvků, které jsou ve vzájemném vztahu k vytvoření molekul, respektovaly zákon zachování hmoty. To znamená, že počet a typy atomů nalezených v molekule jsou stejné jako počet a typy atomů prvků použitých v chemické reakci.
Dalším relevantním tvrzením této teorie byl zákon o více proporcích, podle kterého při konjugaci dvou atomů dvou prvků může ke konjugaci dojít pouze podle poměru celých čísel, jako je 1:1, 2:1, 2:2. , a tak dále. Vezmeme-li jako příklad vodu, je vidět, že H2O se slučuje v poměru 2:1, což znamená, že má dva atomy vodíku a jeden kyslík.
Není tedy možné, aby se jiný podíl těchto prvků dal použít k výrobě vody. Není možné vyrobit vodu pomocí 3 atomů vodíku a dvou atomů kyslíku (3:2).
Dalton byl také schopen vytvořit "Tabulku atomových hmotností" a pomocí dat z této tabulky byl schopen umístit prvky do uspořádání určeného hmotností jejich prvků, z porovnání s vodíkem, který je nejlehčím prvkem. , který je první ve vaší tabulce a má atomové číslo 1.
Model kulečníkové koule
Následkem představy, že atomy jsou nejmenší částice hmoty, bylo umět si je představit jako pevné a tvrdé koule, pro které mnoho z jeho znázornění bylo vyrobeno pomocí modelů vyrobených z dřevěných koulí, díky nimž dostal kulečníkovou kouli. jméno modelu.
Řetězec uvažování Daltonovy teorie dokázal vědecky uspokojivým způsobem vysvětlit dva zákony: Zákon konstantních proporcí, podle kterého je mezi reagujícími látkami pevně stanovena úměrnost, a Zákon více proporcí, podle kterého jsou proporce mezi reagujícími látkami pevně dané. vždy tak učiní v celých číslech.
Prostřednictvím této formulace bylo také možné vysvětlit existenci mnoha elementárních látek, počínaje konečným souborem jednotlivých částic. Později byla vylepšena Rutherfordovou teorií a Atomový model Bohr
Daltonův atomový model je v podstatě jednoduchý kombinatorický model, který by mohl objasnit téměř veškerou chemii své doby a tím i základ pro vývoj a budoucí inovace v oblasti chemie a v různých dalších oblastech vědy.
Daltonovy experimenty
Na rozdíl od atomistů, kteří pouze používali svou logiku ke konceptualizaci atomu, Dalton založil svá tvrzení na velkém počtu experimentů, které prokázaly existenci atomů, provedených výhradně z pohledu chemie. Některé z nejznámějších byly:
Prováděl experimenty s hmotou v plynném skupenství, pozoroval účinky tlaku tohoto skupenství hmoty a dospěl k závěru, že atomy, z nichž se skládají plynné látky, se pohybují v nepřetržitém náhodném pohybu.
Některé z jeho experimentů byly založeny na směsi prvků za účelem vytvoření molekul sloučenin, jejichž výsledky mu umožnily tvrdit, že daná sloučenina bude vždy tvořena stejnými prvky ve stejných poměrech a podle jeho Zákona o více proporcích.
Přijetí daltonského atomového modelu
Daltonova atomová teorie byla široce přijímána mnoha vědci své doby, aniž by na to bylo potřeba mnoho času a stala se základem pro některé části dnešní atomové teorie.
Ačkoli dnes vědci také vědí, že atomy nejsou nejmenší částice hmoty, protože, jak je známo, atomy obsahují několik druhů menších částic, jako jsou protony, neutrony a elektrony. Daltonova teorie byla okamžitě založena jako teoretický základ pro chemii.
Omezení a chyby v Daltonově teorii
Dalton měl hypotézu, že atomy všech prvků zůstaly individuální, díky čemuž si nebyl schopen uvědomit, že v některých prvcích atomy existují v molekulách, jako je tomu v případě čistého kyslíku, který existuje jako O2, tj. molekula téhož prvku se dvěma atomy kyslíku.
Stejně tak jeho myšlenka, že nejjednodušší sloučeninou mezi dvěma prvky je vždy jeden atom každého, byla mylná. Chyba, která ho vedla k závěru, že výraz pro vodu byl HO místo H2O.
Skutečnost, že zařízení, které používal ke svým experimentům, bylo velmi jednoduché, vedlo Daltona k několika nesprávným závěrům. Ve svých začátcích dával kyslíku hodnotu 5.5, což znamená, že byl 5.5krát objemnější než atom vodíku, který používal jako referenční. Tyto hodnoty však dokázal opravit o několik let později a dal kyslíku hodnotu 7, a to navzdory skutečnosti, že jiní vědci jeho doby uváděli kyslíku hodnotu 8.
Dopad Daltonovy teorie
Je pravda, že současná atomová teorie dosáhla úrovní, které byly před několika lety nepopsatelné, ale Daltonova genialita spočívá v tom, že základní principy jeho teorie jsou v určitých ohledech stále platné. Dnes je však známo, že atomy lze oddělit pomocí reakcí na jaderné úrovni, ale to neznamená, že již neplatí Daltonovo tvrzení, že je nelze oddělit pomocí chemických reakcí.
Kromě toho je dnes také známo, že ne všechny atomy téhož prvku mají stejnou hmotnost, protože bylo možné prokázat, že existují izotopy, což jsou atomy s dalšími neutrony, a že mají větší hmotnost, i když je stejný prvek.
Daltonův životopis
John Dalton se narodil v Anglii 6. září 1766, jeho rodina byla skromná a jeho rané vzdělání bylo od rodičů a ze školy v jeho městě. Vzhledem ke svému původu a ekonomické situaci své rodiny musel v 10 letech nastoupit do zaměstnání, sloužit v domě, i když se také uvádí, že ve 12 letech začal učit na škole a ve 14 letech se stal zběhlý v latině.
Dalton pokračoval ve výuce a přijímal neformální výuku od instruktorů v oblasti, ve které žil, a když dosáhl věku 27 let, byl jmenován profesorem matematiky a přírodní filozofie na malé univerzitě v Manchesteru, což byla pozice, ve které pokračoval. několik let, 7 let, dokud se nerozhodnu stát se soukromým učitelem stejných předmětů.
Vědecké příspěvky
Mezi jeho nejdůležitější příspěvky bezpochyby patří jeho teorie atomu, ale John Dalton prováděl studie a experimenty na:
- Meteorologie.
- Měření výšek hor.
- Barvoslepost, stav, který byl později na jeho počest pojmenován daltonismus.
- Některé zákony týkající se plynů.
A vydal mnoho dalších publikací svých děl o vedlejších tématech, například o barvě oblohy a dokonce o anglické gramatice.
Dalton byl muž rezervovaného charakteru a nikdy se neoženil. Věnoval se výhradně svému výzkumu a vedl skromný život bez většího povyku. V letech 1837 a 1838 trpěl záchvaty, které vyústily v oněmělost, ale to mu nebránilo pokračovat ve vyšetřování až do roku své smrti, v roce 1844.