El Bohrův atomový model pokuste se vysvětlit, jak jsou prvky uspořádány v atomu. Z toho bylo možné odvodit, že pohyb atomů po kruhových drahách a jejich přemísťování mezi jednou a druhou dráhou byly schopny produkovat zvýšení nebo ztráty energie. Zde se můžete dozvědět více o atomová teorie Booh

Atomový Bohrův model
Dostal také název modelu Rutherford-Bohr. Byl vyvinut v roce 1913 na základě Rutherfordova modelu, který, přestože byl úspěšný a revoluční, měl určité konflikty s Maxwellovými zákony a Newtonovými zákony, protože se dospělo k názoru, že všechny atomy jsou nestabilní.
Rutherfordův atomový model byl založen na skutečnosti, že pohybující se elektrony, které mají záporný elektrický náboj, by měly šířit elektromagnetické záření podle zákonů elektromagnetismu. Za předpokladu, že by tomu tak bylo, ztráta energie by způsobila, že elektrony stlačí svou oběžnou dráhu, spirálovitě se pohybují směrem ke středu atomu a poté se zhroutí do jádra.
Nové nápady
El Bohrův atomový model dal řešení tohoto problému a tvrdil, že elektrony obíhají na oběžné dráze kolem jádra, ale pouze na některých povolených drahách a s určitou energií, která je úměrná Planckově konstantě.
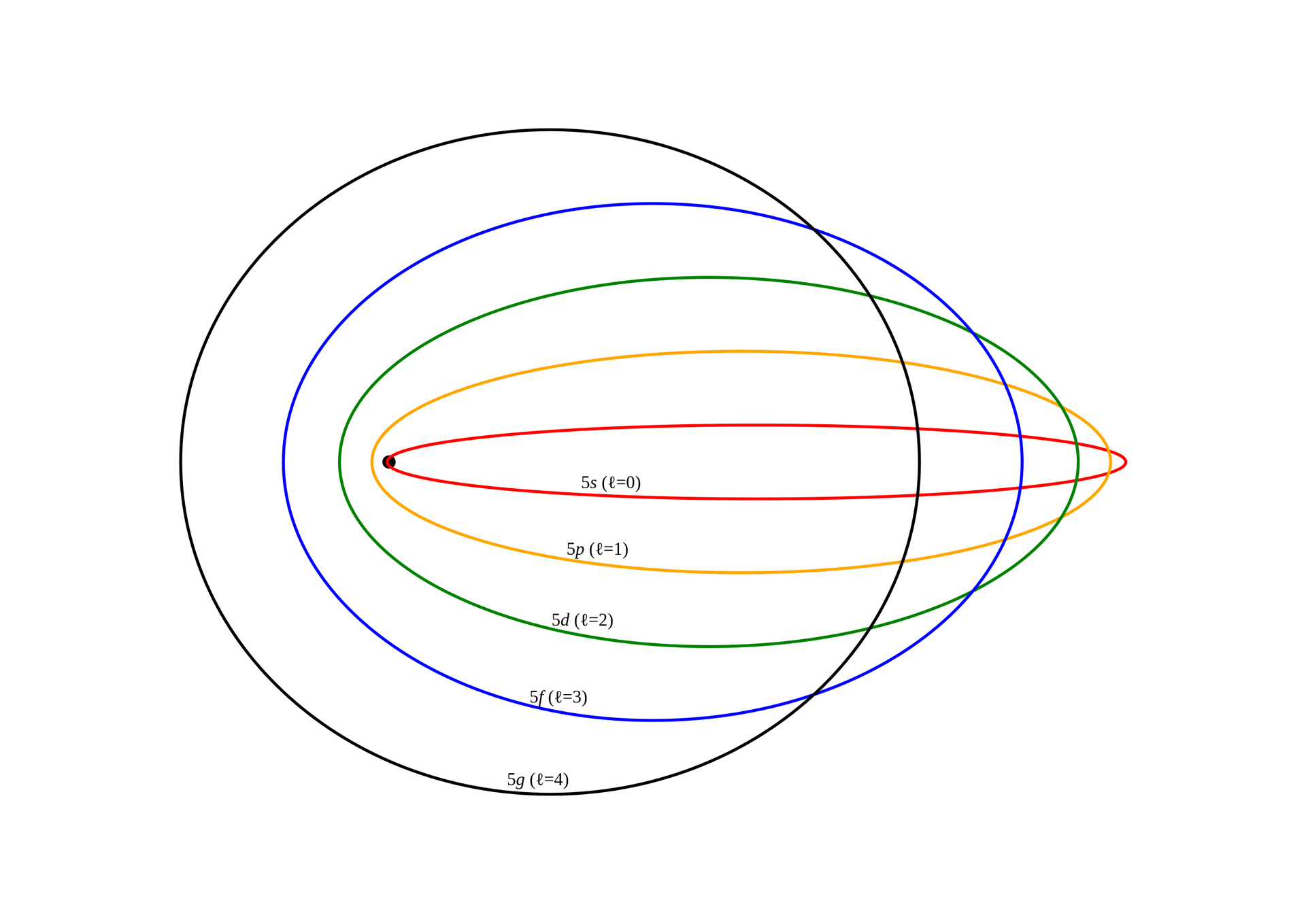
Tyto povolené dráhy dostaly název energetické skořápky nebo energetické hladiny. To znamená, že energetická kapacita elektronu uvnitř atomu není spojitá, ale je kvantifikována na určité úrovni.
Tyto úrovně jsou identifikovány kvantovým číslem n (n = 1, 2, 3 a více) a podle Bohra by toto kvantové číslo mohlo být stanoveno pomocí Rybergova vzorce, což je pravidlo vytvořené v roce 1888 švédským fyzikem Johannesem Rybergem. reprezentovat vlnové délky spektrálních čar mnoha chemických prvků.
Tento vzorec energetických hladin naznačoval, že elektrony mohou zvýšit nebo snížit svou energii pouze tehdy, pokud se jim podaří přeskočit z jedné konkrétní oběžné dráhy na druhou, a když k tomu dojde, elektron by během procesu vyzařoval nebo absorboval elektromagnetické záření.
El Bohrův atomový model šlo o modifikaci Rutherfordova modelu. Z toho důvodu přetrvaly zvláštnosti malého centrálního jádra s většinou hmoty. Stejně tak elektrony prováděly svůj orbitální pohyb kolem jádra, podobně jako planety kolem Slunce, ale jejich orbitální pohyby nebyly ploché.
Základní principy Bohrova atomového modelu
Nabité částice s elektrickou energií kladného znaménka se nacházejí ve velmi malých množstvích, pokud je porovnáme s objemem atomu a zahrnou největší část hmotnosti atomu. Zatímco elektrony, které mají záporný elektrický náboj, se pohybují kolem jádra po kruhových drahách, které již mají předem určenou velikost a energii. Z tohoto důvodu neexistují v mezilehlé poloze mezi oběžnými drahami.
Energie oběžné dráhy má vztah úměrný její velikosti. Nejnižší energie se nachází na oběžné dráze s nejmenším obvodem. Čím dále je energetická hladina od jádra, tím větší množství energie má.
Různé energetické hladiny mají různý počet elektronů. Čím nižší je hladina energie, tím méně elektronů má. Například v úrovni 1 budou až 2 elektrony, v úrovni 2 až 8 elektronů a tak dále. Energie je tedy vyzařována nebo absorbována v okamžiku, kdy se elektron změní z jedné dráhy na druhou.
Další úvahy o Bohrově atomovém modelu
Důvod bytí Bohrův atomový model bylo vysvětlit, že hmota zůstává stabilní, což předchozí atomové modely nedělaly, stejně jako absorpční a ozařovací spektra plynů.
Bohr's byl první, kdo použil koncept kvantování, který jej řadí mezi model klasické mechaniky, jako je např. Příspěvky Blaise Pascala a kvantově mechanický model. Zdokonalil Rutherfordův model začleněním kvantizačních objevů Maxe Plancka o několik let dříve a teorií Alberta Einsteina.
Přes své nedostatky, Bohrův atomový model byl předchůdcem zrodu kvantové mechaniky iniciovaného Schrödingerem a dalšími vědci, stejně jako Plankova kvantová teorie.
Omezení a chyby v Bohrově modelu
Model nevysvětluje, proč jsou elektrony jedinečně omezeny na určité dráhy.
V modelu bylo uvedeno, že elektrony mají známý poloměr a oběžnou dráhu, což by princip neurčitosti Wernera Heisenberga o deset let později vyvrátil.
El Bohrův atomový model měl schopnost reprodukovat chování elektronů v atomech vodíku, ale jeho vzorce nebyly použitelné pro atomy jiných prvků, které měly větší počet elektronů.
Tento atomový model představoval nesrovnalosti, pokud šlo o vysvětlení Zeemanova jevu. Tento efekt je to, co lze pozorovat, když jsou spektrální čáry rozděleny na dvě nebo více, v přítomnosti vnějšího a nepohyblivého magnetického pole.
Stejně tak Bohrův atomový model dodává chybnou hodnotu orbitálního momentu hybnosti hmoty v základním stavu.
Všechny tyto důvody vedly k Bohrův atomový model Po letech ji nahradila kvantová teorie, produkt vědecké práce Heisenberga a Schrodingera.
Kdo byl Niels Bohr?
Niels Bohr byl fyzik narozený ve městě Kodaň v Dánsku v říjnu 1885. Jeho otec byl univerzitním profesorem a matka byla dcerou bohaté rodiny. Měl příležitost vstoupit na univerzitu v Kodani v roce 1903, aby mohl studovat fyziku, ale také studoval astronomii a matematiku. V roce 1911 se mu podařilo získat doktorát.
Také v roce 1911 se mu díky získání stipendia od Carlsberg Foundation, která své prostředky věnovala studiu atomu, podařilo vycestovat do Londýna a během svého pobytu se setkal s významnými vědci, jako byli JJ Thomson a Ernest Rutherford.
V roce 1912 se vrátil do Dánska a oženil se s Margrethe Norludovou, se kterou měl šest dětí, z nichž jedno se stalo uznávaným fyzikem, který získal v roce 1975 Nobelovu cenu, stejně jako před lety jeho otec.
Usadil se v Dánsku a kvůli nepopulárnosti fyziky ve své zemi byl nucen učit studenty medicíny, což se Bohrovi nelíbilo. Později se vrátil do Manchesteru v Anglii, kde mu Rutherford nabídl místo. Zůstal v Londýně až 2 roky po začátku první světové války.
Ředitel fyziky a Nobelova cena
V roce 1916 byl jmenován ředitelem teoretické fyziky na univerzitě v Kodani, což byla funkce vytvořená speciálně pro něj. V roce 1918 přesvědčil vládu, aby vytvořila Dánský institut pro teoretickou fyziku, dnes známý jako Niels Bohr Institute, který zahájil svou cestu v roce 1921 s ním jako jeho hlavním ředitelem.
V roce 1922 mu byla udělena Nobelova cena za fyziku za jeho práci ve výzkumu atomů a záření, které vyzařují. Poté, v roce 1924, se Bohr setkal s Heisenbergem v Dánsku a později měl příležitost přijmout vědce jako Paul Dirac a Erwin Schrödinger, kterým se podařilo utvářet myšlení a interpretaci kvantové mechaniky v Kodani.
Bohr zemřel 18. listopadu 1962 v Carlsbergu v Dánsku, ale byl otcem moderní fyziky ve své zemi.
Doufáme, že toto čtení na Bohrův atomový model byl zajímavý a zveme vás, abyste se dozvěděli více o našem vědeckém obsahu.