La gran història de com Dmitry Ivanovich Mendeleev va publicar la primera versió de la taula que explica tot el que hi ha.
Cada any, milions d'estudiants de secundària a tot el món són davant d'una taula acolorida, plena de lletres i números, que d'alguna manera compta tot l'univers. Aquest testimoni de qui som i de què està fet tot és la taula periòdica dels elements, que el 2019 va fer 150 anys.
Va ser el químic rus Dmitrij Ivanovich Mendeleev qui va trobar la manera d'ordenar l'oxigen, el carboni, el ferro i tots els altres elements descoberts –i encara per descobrir– en una taula per poder classificar-los. La seva intuïció es va fer pública per primera vegada el 6 de març de 1869, però la història de la taula periòdica va començar molt abans i diu molt sobre com funciona la investigació científica: la manera com intentem entendre el món.
La llista de Lavoisier
La majoria dels historiadors de la ciència remunten els orígens de la taula periòdica als estudis realitzats pel químic francès Antoine-Laurent de Lavoisier, a finals del segle XVIII. Abans de trobar un final molt dolent, condemnat a mort per decapitació pel tribunal revolucionari francès, Lavoisier va ser responsable d'alguns dels avenços més importants en la investigació científica del temps. Juntament amb la seva esposa Marie-Anne, va dedicar molts anys a l'estudi dels elements: substàncies com l'oxigen i el carboni que no es poden «descompondre» per reacció química en altres substàncies. Lavoisier també va enunciar la primera versió de la llei de conservació de la massa, després d'haver entès que en una reacció química la suma dels pesos de les substàncies inicials ha de ser igual a la de les substàncies obtingudes després de la reacció.
En 1789 Lavoisier va publicar una llista inicial dels 33 elements identificats fins aquell moment, sabent que probablement en quedaven molts més per descobrir (la seva llista mostrava al voltant d'una cinquena part dels que es coneixen avui). L'or, el ferro i el sofre es coneixen des de l'antiguitat, mentre que d'altres s'han descobert més recentment. Encara que incompleta, la llista va ser el primer intent de posar els elements en ordre, un trencaclosques molt complicat que faria més d'un segle que resoldre i moltes dècades més per completar amb gairebé totes les peces.

Proust i Dalton
Cinc anys després de la publicació de la seva llista, Lavoisier va ser condemnat a mort pel tribunal popular revolucionari i va ser decapitat. Era 1794, el mateix any que un altre científic, Louis-Joseph Proust, havia arribat a la conclusió que si la llei de conservació de Lavoisier era vàlida, aleshores calia afegir una nova peça relacionada amb les «proporcions definides». Proust va enunciar la seva nova llei el 1799: quan dos o més elements reaccionen entre si formant un compost, sempre es componen segons proporcions de massa definides i constants.
Tot i que la seva llei suggeria que els compostos químics havien d'estar fets de partícules de diferents pesos, cadascuna atribuïble a un element donat. Va ser el científic britànic John Dalton (a qui devem el terme «daltonisme»: que no podia veure alguns colors i va ser un dels principals estudiosos d'aquesta condició) qui va demostrar a principis del segle XIX que quan dos elements es combinen per formar compostos, una quantitat d'un element se combina amb quantitats que són múltiples de l'altre, que es relacionen entre si com a petits nombres enters.
Bàsicament, si combino 12 grams de carboni amb 16 grams d'oxigen, obtinc monòxid de carboni (CO), però si combino els primers amb el doble d'oxigen, obtinc diòxid de carboni (CO2). Amb la mateixa massa de carboni, el diòxid de carboni conté el doble d'oxigen que el monòxid de carboni. D'això se'n dedueix que el valor de la relació de combinació és la meitat.
«Coses» diminutes a l'ull humà, els àtoms
Per explicar la seva llei, Dalton va assumir que cada element estava compost de diminutes coses invisibles a l'ull humà, totes amb el mateix pes. Els va anomenar «àtoms», reprenent la paraula grega utilitzada per definir una cosa indivisible.

Posant ordre
En pocs anys Lavoisier, Proust i Dalton havien formalitzat les tres lleis clàssiques de la química (lleis del pes), demostrant el potencial del mètode científic i els ràpids avenços en una disciplina fonamental per entendre com funciona el món, però calia posar ordre entre tantes novetats.
Entre els primers a fer això va estar el químic suec Jons Jacob Berzelius, qui va introduir abreviatures per als elements, usant una o dues lletres com «C» per al carboni i «Fe» per al ferro. A les abreviatures va afegir números per indicar les proporcions dels diversos elements: com el «2» a H2O, que indica les dues parts d'hidrogen unides a una oxigen per formar la molècula d'aigua. Aquestes lletres i números haurien acabat a la taula periòdica d'elements i continuen sent essencials avui dia.
Berzelius era un tipus força creatiu i inquisitiu. Després de conèixer la pila elèctrica inventada per l'italià Alessandro Volta, i que produïa electricitat mitjançant una reacció química, va començar a experimentar per intentar obtenir l'efecte contrari. Va utilitzar l'electricitat de la bateria per induir reaccions químiques en solucions, anomenades electròlisi.
Aquesta tècnica, adoptada per diversos científics, va demostrar ser fonamental per descobrir una àmplia varietat d'elements químics prèviament desconeguts. En pocs anys es van identificar elements l'existència dels quals ara sembla haver-se donat sempre per feta, com el sodi, el magnesi, el potassi i el calci. Es van afegir dotzenes de nous elements a la trentena enumerada per Lavoisier, fet que va generar noves preguntes: quants elements hi ha realment a la natura? Com podem descobrir els altres? Hi ha substàncies que pensem que són el resultat de la unió d'altres elements i que en canvi són elements en ells mateixos?

La taula periòdica
A mesura que continuava la carrera pels elements, molts científics van començar a preguntar-se com ordenar i donar sentit als seus nous descobriments. Per això, calia examinar les substàncies individuals i comparar-ne les característiques a la recerca de coses en comú. Es va descobrir que alguns elements podien agrupar-se en trios i classificar-se per pes atòmic: l'element del centre sempre tenia un pes igual al pes mitjà entre els dos companys més lleugers i més pesats.
A principis de la dècada de 1860, els químics tenien a la seva disposició tres lleis fonamentals, dotzenes d'elements, el coneixement d'alguna característica recurrent entre ells, però cap sistema de catalogació per orientar-se al món que havien descobert. Posar la química en ordre es va convertir gairebé en una obsessió per a un professor de química de la Universitat de Sant Petersburg a Rússia: Dmitry Ivanovich Mendeleev. A finals de febrer i principis de març de 1869, Mendeleev va treballar per donar sentit als elements. Va ser literalment un compromís continu: va treballar dia i nit, perdent finalment la noció del temps i arribant a dir, més tard, que la idea definitiva per resoldre el trencaclosques de la química se li havia acudit després d'un somni breu.
Creació de la taula periòdica
Mendeleev va crear una taula en què s'enumeraven els elements segons un criteri precís, que tenia en compte les relacions entre les seves característiques. El sistema va ser millor que altres intents anteriors per una senzilla raó: era més honest. És a dir, contemplava la possibilitat que hi hagués altres elements per descobrir i que, per tant, era normal que algunes caselles de l'esquema fossin buides. Mendeleev va atreure moltes crítiques per haver deixat aquests forats, però els descobriments de les dècades següents li donarien la raó.
La taula no només contemplava la possibilitat que es descobrissin nous elements: també qüestionava si alguns dels mesuraments realitzats fins aleshores sobre alguns eren precises. A la taula, Mendeleev va invertir alguns elements que sustenten aquesta teoria. En alguns casos, mesures més precises li van donar la raó, en altres casos no, demostrant que als científics de l'època encara els faltava alguna cosa sobre el pes atòmic.

L'evolució de la taula de Mendeleev
La bellesa de la taula periòdica d'elements, possiblement la quadrícula preferida dels químics, és que no sembla un patró uniforme. Algunes files tenen un grapat d'elements, mentre que d'altres es completen amb 18 elements. S'anomena «periòdic» perquè Mendeleev va explotar la recurrència de les propietats químiques, agrupant elements amb característiques químiques similars.
Amb el descobriment de nous elements en els anys següents, inclòs el sorprenent per a lèpoca dels gasos nobles (com lheli), inerts i, per tant, difícils de detectar, la taula de Mendeleev va demostrar ser un punt de partida formidable per refinar un esquema que ho abraça tot dels elements, malgrat les complicacions que porten noves intuïcions i evidències científiques. A finals del segle XIX, per exemple, es va descobrir que els àtoms podien perdre peces, el que suggeria que ells mateixos estaven formats per parts més petites i encara no observades.
Estructura química
Un cop més, en unes poques dècades, la química va fer passos de gegant que van conduir a la formulació de teories sobre l'estructura atòmica. Van descobrir coses que avui dia donem per assegudes, com l'existència de protons (amb càrrega positiva), neutrons (sense càrrega) i electrons (amb càrrega negativa), és a dir, els components subatòmics. Això va conduir a la determinació del nombre atòmic, que indica el nombre de protons continguts en un nucli atòmic.
No obstant això, en no tenir coneixement disponible el 1869, Mendeleev havia ordenat el seu esquema sobre el pes atòmic (tot i que amb alguna substitució en l'ordre dels elements perquè el disseny general encaixés). Sense voler, Mendeleev havia ordenat els elements en ordre de nombre atòmic, anys abans que s'introduís aquest mateix concepte. La substitució dels números atòmics en els valors de la taula va donar lloc a la seqüència definitiva de la taula periòdica que coneixem avui. A més del descobriment de l'estructura de l'àtom, al segle XX la mecànica quàntica hauria donat lloc a evolucions i refinaments més grans de la taula periòdica, que es reflecteixen en el model actual de 18 columnes.
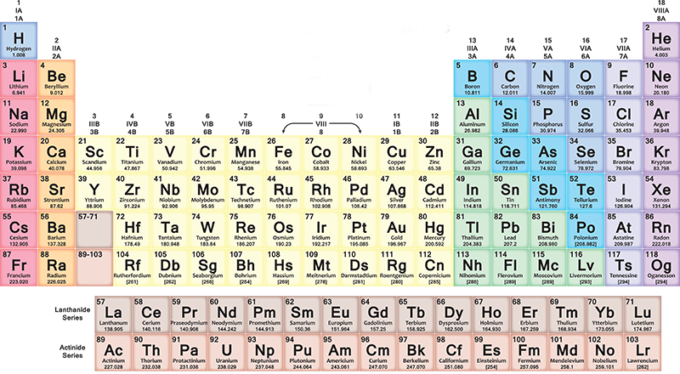
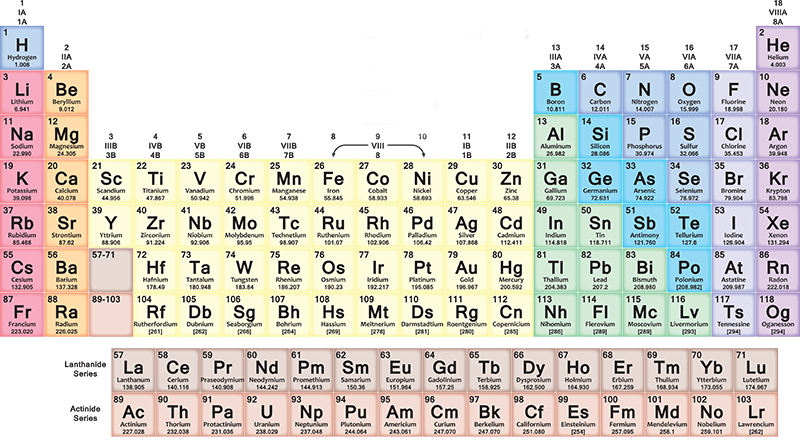
Com es fa i llegeix la taula periòdica
A la taula periòdica, els elements s'insereixen progressivament a cada fila (període) d'esquerra a dreta segons la seqüència dels números atòmics: cada nova fila comença després d'un gas noble. El primer element de la fila sempre és un metall alcalí, amb un nombre atòmic u més gran que l'element amb què va acabar la fila anterior. Més generalment, a les set files de la taula, els metalls són a l'esquerra i altres tipus d'elements a la dreta.
Així que a mesura que avances cap a la dreta trobaràs elements cada cop més pesats, amb diferents característiques des de metall fins a gas. Quan arribeu al final d'una fila i comenceu la següent, sempre d'esquerra a dreta, la distribució es repeteix cíclicament. Tot torna amb una certa harmonia, que et deixarà sorprès si intentes llegir la taula fixant-t'hi.
Les columnes (grups o famílies) contenen elements amb característiques químiques semblants. Per exemple, tenen la mateixa configuració electrònica externa, és a dir, electrons que es comporten de la mateixa manera al voltant del nucli dels seus àtoms. Hi ha 18 grups i van des del grup dels metalls alcalins fins al dels gasos nobles.
No tots els elements són naturals
Els elements amb números atòmics de l'1 al 118 ocupen les set files de la taula periòdica: els primers 94 són tots naturals, mentres que els del 95 al 118 s'han obtingut artificialment. Les investigacions per desenvolupar nous elements encara estan en progrés, així com també hi ha alguns problemes per resoldre a l'organització actual de l'esquema.
Tot i alguns ajustaments, en general en els seus 150 anys d'existència, la taula periòdica d'elements ha demostrat ser essencial no només per ordenar els elements que ho componen tot, inclosos els ulls que utilitza per llegir aquestes paraules, sinó també per analitzar la química de les reaccions, descobrir relacions entre diferents compostos i estudiar física nuclear. Les files i columnes del quadre són una síntesi incomparable del que va ser la investigació científica que en va fer possible la creació i, en cert sentit, del que serà.