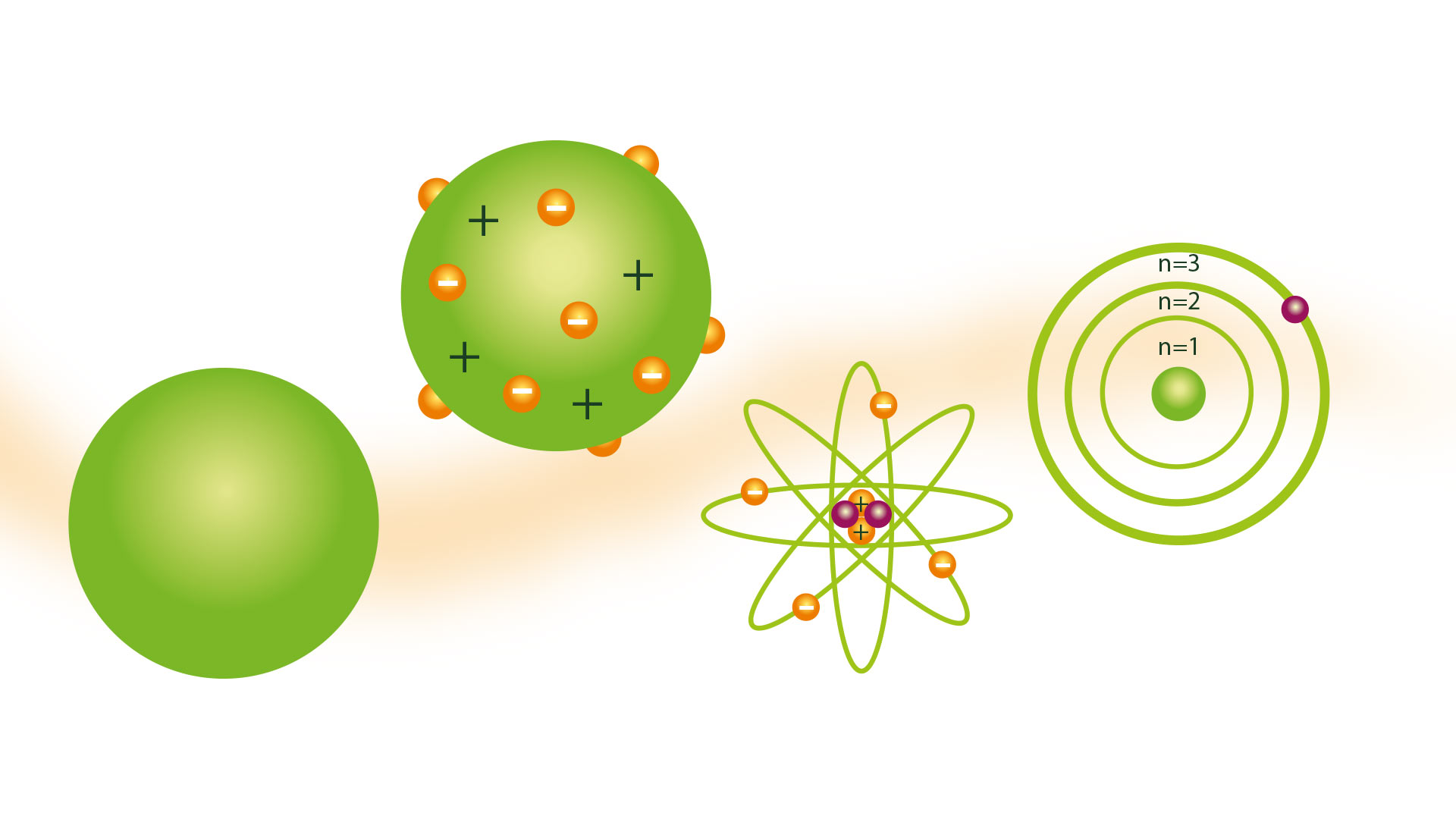
Pojam atoma kako ga je predstavio grčki filozof Demokrit nisu dijelili mnogi naučnici tokom stoljeća. Ali 1804. godine dalton atomski model, zasnovano na teorijama grčkih atomista, što je prihvaćeno.

Daltonov atomski model
Nakon atomističke misli i grčkih filozofskih ideja, prošlo je oko 2 hiljade godina dok nova atomska teorija nije postala poznata naučnom svijetu. Njegovo porijeklo je u istraživanju Johna Daltona, koji je bio britanski fizičar, hemičar i meteorolog i bio je promotor prve moderne atomske teorije.
Moglo bi se reći da je Dalton bio ono što se zvalo potpuni naučnik, jer njegove studije nisu bile ograničene na fiziku, naprotiv, bio je i nadaleko poznat po svojim istraživanjima o nemogućnosti da se boje prepoznaju ljudskim okom, stanje koje je zahvaljujući njemu danas poznato kao daltonizam.
Njegov atomski model bio je poznat kao model bilijarske lopte i predstavljen je 1804. Dalton je bio naučni istraživač i njegov model je bio proizvod do kojeg je došao nakon zaključaka koji su bili rezultat više eksperimenata koje je izvodio s plinovima. On je bio preteča teorija kao što su Rutherfordov atomski model.
Uzimajući za osnovu zaključke i efekte svog rada, Dalton je uspio dokazati da atomi o kojima su Grci govorili zaista postoje, što je pitanje koje je Atomska teorija Demokrita samo je skicirao, uspevši da uspostavi prvu naučno utemeljenu teoriju postojanja atoma u istoriji moderne fizike.
Osnovni principi Daltonovog atomskog modela
Daltonov atomski model bio je prvi vizualizirani pokušaj mehanizma, konformacije i lokacije atoma, zamišljen između 1803. i 1807. godine, John Dalton mu je prvi dao naziv atomska teorija i na osnovu njega napravio sljedeće premise:
prvi postulat
Utvrdio je da se sva materija sastoji od elementarnih čestica, zvanih atomi, i da se ne može ni podijeliti ni uništiti. Oni također nisu mogli biti stvoreni ili promijenjeni u hemijskoj reakciji.
drugi postulat
Atomi koji čine bilo koji element identični su jedni drugima, ne samo po težini, već i po drugim karakteristikama. Dakle, svi atomi kiseonika su apsolutno jednaki. Umjesto toga, atomi različitih elemenata međusobno se razlikuju po svojoj težini. Zahvaljujući ovom postulatu, došlo je do saznanja o relativnoj atomskoj težini, kroz poređenje različitih atoma sa onom vodonika, koja je prema Daltonu bila najjednostavnija.
treći postulat
Atomi se ne mogu podijeliti, bez obzira na vrstu kemijskog djelovanja na njih. Kombinacija istih ili različitih atoma će dovesti do složenijih spojeva ili supstanci, ali uvijek počevši od atoma kao minimalne osnovne jedinice materije.
četvrti postulat
Kombinacija atoma jedan s drugim, kako bi se formirala jedinjenja, uvijek će otkriti odnos koji se može izraziti jednostavnim i potpunim brojevima. Nikada u razlomcima, jer se atomi ne mogu podijeliti. To je ono što se dešava sa kiseonikom, koji formiraju dva jednaka atoma (O2), ili sa vodom, koja su dva jednaka i jedan različita (H2O).
peti postulat
Kombinacijom atoma nasumičnih elemenata u različitim količinama mogu se formirati brojni različiti spojevi. Ovo je jedini način na koji se može objasniti da je, počevši od konačnog broja atoma, izgrađena sva materija u svemiru. Kao primjer ove ideje, atom ugljika i dva atoma kisika će formirati spoj (CO2), ali samo jedan od svakog elementa će formirati različito jedinjenje (CO).
šesti postulat
Sva hemijska jedinjenja nastaju kada se atomi dva ili više različitih elemenata spoje, na stalan i jednostavan način. Ali, prema Daltonova teorija, atomi istog elementa u početku ne pokazuju nikakav afinitet jedni prema drugima, samo u prisustvu različitih atoma.
Daltonovi zakoni
Kao posledica ovih postulata, formulisani su sledeći zakoni:
- Sva materija je sastavljena od atoma.
- Apsolutno sve što je poznato sastoji se od atoma, kako na Zemlji tako i u poznatom svemiru. Svaki od elemenata se sastoji od atoma.
- Atomi su nedjeljivi i neuništivi.
- Atomi su najmanje čestice materije.
- Svi atomi datog elementa su identični.
- U određenom elementu, svi njegovi atomi imaju istu masu i iste karakteristike.
- Atomi različitih elemenata razlikuju se po masi i svojstvima.
- Svaki element se sastoji od atoma različitih karakteristika i mase.
- Jedinjenja se sastoje od kombinacije dvije ili više različitih vrsta atoma.
- Konkretno jedinjenje uvijek ima iste vrste atoma u kombinaciji iu istim omjerima.
- Hemijska reakcija je preuređenje atoma.
- Hemijske reakcije su proizvod razdvajanja, spajanja ili preuređivanja atoma. Ali, atomi jednog elementa nikada ne postaju atomi drugog elementa kao rezultat hemijske reakcije.
Dodatna razmatranja Daltonovog atomskog modela
Uz kreiranje osnovnih principa navedenih gore, Dalton je predložio da atomi dva elementa koji su međusobno povezani kako bi formirali molekule poštuju Zakon održanja mase. To znači da su broj i vrste atoma pronađenih u molekulu isti kao i broj i tipovi atoma elemenata koji se koriste u kemijskoj reakciji.
Još jedna relevantna izjava ove teorije bio je Zakon višestrukih proporcija, prema kojem kada su dva atoma dva elementa konjugirana, konjugacija se može dogoditi samo prema omjeru cijelih brojeva kao što su 1:1, 2:1, 2:2 , i tako dalje. Ako se za primjer uzme voda, vidi se da se H2O kombinuje u omjeru 2:1, što znači da ima dva atoma vodika i jedan kisik.
Stoga nije moguće da se drugačiji udio ovih elemenata može koristiti za proizvodnju vode. Nije moguće proizvesti vodu koristeći 3 atoma vodika i dva atoma kisika (3:2).
Dalton je takođe mogao da napravi „Tabelu atomskih težina“ i koristeći podatke iz te tabele, mogao je da postavi elemente u raspored određen težinom njihovih elemenata, iz poređenja sa vodonikom, koji je najlakši element. , koji je prvi u vašoj tabeli i ima atomski broj 1.
Model lopte za bilijar
Posljedica ideje da su atomi najmanje čestice materije bila je mogućnost da ih zamislimo kao čvrste i tvrde sfere, za koje su mnoge njegove predstave napravljene po modelima napravljenim od drvenih sfera, zahvaljujući kojima je dobio bilijarsku kuglu. naziv modela.
Lanac rasuđivanja Daltonove teorije bio je u stanju da na naučno zadovoljavajući način objasni dva zakona: zakon konstantnih proporcija, prema kojem je proporcionalnost fiksirana između reagujućih supstanci, i zakon višestrukih proporcija, prema kojem su proporcije između supstanci koje reaguju uvijek će to činiti u cijelim brojevima.
Kroz ovu formulaciju također je bilo moguće objasniti postojanje brojnih elementarnih supstanci, počevši od konačnog skupa sastavnih čestica. Kasnije je poboljšana Rutherfordovom teorijom i Bohrov atomski model
Daltonov atomski model je u suštini jednostavan kombinatorni model, koji bi mogao dati pojašnjenje gotovo cjelokupnoj hemiji svog vremena, a time i temelj za razvoj i buduće inovacije u području kemije i u raznim drugim područjima znanosti.
Daltonovi eksperimenti
Suprotno atomistima, koji su svoju logiku koristili samo za konceptualizaciju atoma, Dalton je svoje tvrdnje zasnovao na velikom broju eksperimenata koji su dokazali postojanje atoma, izvedenih u potpunosti iz perspektive kemije. Nekoliko najpoznatijih su:
Izveo je eksperimente sa materijom u gasovitom stanju, posmatrajući efekte pritiska tog stanja materije, došavši do zaključka da se atomi od kojih se sastoje gasovite materije nalaze u neprekidnom slučajnom kretanju.
Neki od njegovih eksperimenata bili su zasnovani na mješavini elemenata za stvaranje molekula jedinjenja, čiji su mu rezultati omogućili da tvrdi da će dato jedinjenje uvijek biti sastavljeno od istih elemenata u istim omjerima i slijedeći njegov Zakon višestrukih proporcija.
Prihvatanje Daltonovog atomskog modela
Daltonovu atomsku teoriju široko su prihvatili mnogi naučnici njegovog vremena bez mnogo vremena za nju i postala je osnova za neke dijelove današnje atomske teorije.
Iako danas naučnici znaju i da atomi nisu najsitnije čestice materije, jer, kao što je poznato, atomi sadrže nekoliko vrsta manjih čestica, kao što su protoni, neutroni i elektroni. Daltonova teorija je odmah uspostavljena kao teorijska osnova za hemiju.
Ograničenja i greške u Daltonovoj teoriji
Dalton je imao hipotezu da su atomi svih elemenata ostali individualni, zbog čega nije mogao shvatiti da u nekim elementima atomi postoje u molekulama, kao što je slučaj čistog kisika koji postoji kao O2, tj. molekula istog elementa sa dva atoma kiseonika.
Isto tako, njegova ideja da je najjednostavniji spoj između dva elementa konstantno jedan atom svakoga bila je pogrešna. Greška koja ga je navela da zaključi da je izraz za vodu bio HO umjesto H2O.
Činjenica da je oprema koju je koristio za svoje eksperimente bila vrlo osnovna dovela je Daltona do nekoliko pogrešnih zaključaka. U svojim počecima davao je kisiku vrijednost 5.5, što znači da je bio 5.5 puta veći od atoma vodika, koji je koristio kao referencu. Međutim, uspio je ispraviti te vrijednosti godinama kasnije, dajući kisiku vrijednost 7, uprkos činjenici da su drugi istraživači njegovog vremena davali kisiku vrijednost 8.
Utjecaj Daltonove teorije
Istina je da je trenutna atomska teorija dostigla nivoe koji su bili neopisivi prije nekoliko godina, ali Daltonov genij je u tome što su suštinski principi njegove teorije još uvijek na snazi u određenim aspektima. Međutim, danas je poznato da se atomi mogu razdvojiti reakcijama na nuklearnom nivou, ali to ne znači da više ne vrijedi Daltonova izjava da se ne mogu razdvojiti kemijskim reakcijama.
Osim toga, danas je poznato i da nemaju svi atomi istog elementa istu masu, jer je bilo moguće dokazati da postoje izotopi, a to su atomi s dodatnim neutronima, te da imaju veću masu čak i kada je isti element.
Daltonova biografija
Džon Dalton je rođen u Engleskoj 6. septembra 1766. godine, njegova porodica je bila skromna, a rano obrazovanje stekao je od roditelja i škole u njegovom gradu. Zbog porekla i ekonomskog stanja porodice morao je da počne da radi sa 10 godina, u kući, mada se navodi i da je u školi počeo da predaje sa 12 godina, a da je sa 14 postao vešt latinskim jezikom.
Dalton je nastavio da predaje i prima neformalne instrukcije od instruktora u oblasti u kojoj je živio, a kada je navršio 27 godina dobio je imenovanje za profesora matematike i prirodne filozofije na malom univerzitetu u Manchesteru, poziciju na kojoj je nastavio nekoliko godina, 7 godina, dok ne donesem odluku da postanem privatni predavač za te iste predmete.
Naučni doprinosi
Bez sumnje, među njegovim najrelevantnijim doprinosima je njegova teorija atoma, ali John Dalton je proveo studije i eksperimente na:
- Meteorologija.
- Mjerenja visina planina.
- Daltonizam, stanje koje je kasnije u njegovu čast nazvano daltonizam.
- Neki zakoni koji se odnose na gasove.
I objavio je mnoge druge publikacije svojih radova o manjim temama, poput one koja se odnosi na boju neba, pa čak i na englesku gramatiku.
Dalton je bio čovjek suzdržanog karaktera i nikada se nije ženio. Posvetivši se isključivo svom istraživanju, vodio je skroman život bez puno buke. Godine 1837. i 1838. patio je od napada zbog kojih je postao nijem, ali to ga nije spriječilo da nastavi istragu, sve do godine njegove smrti, 1844.