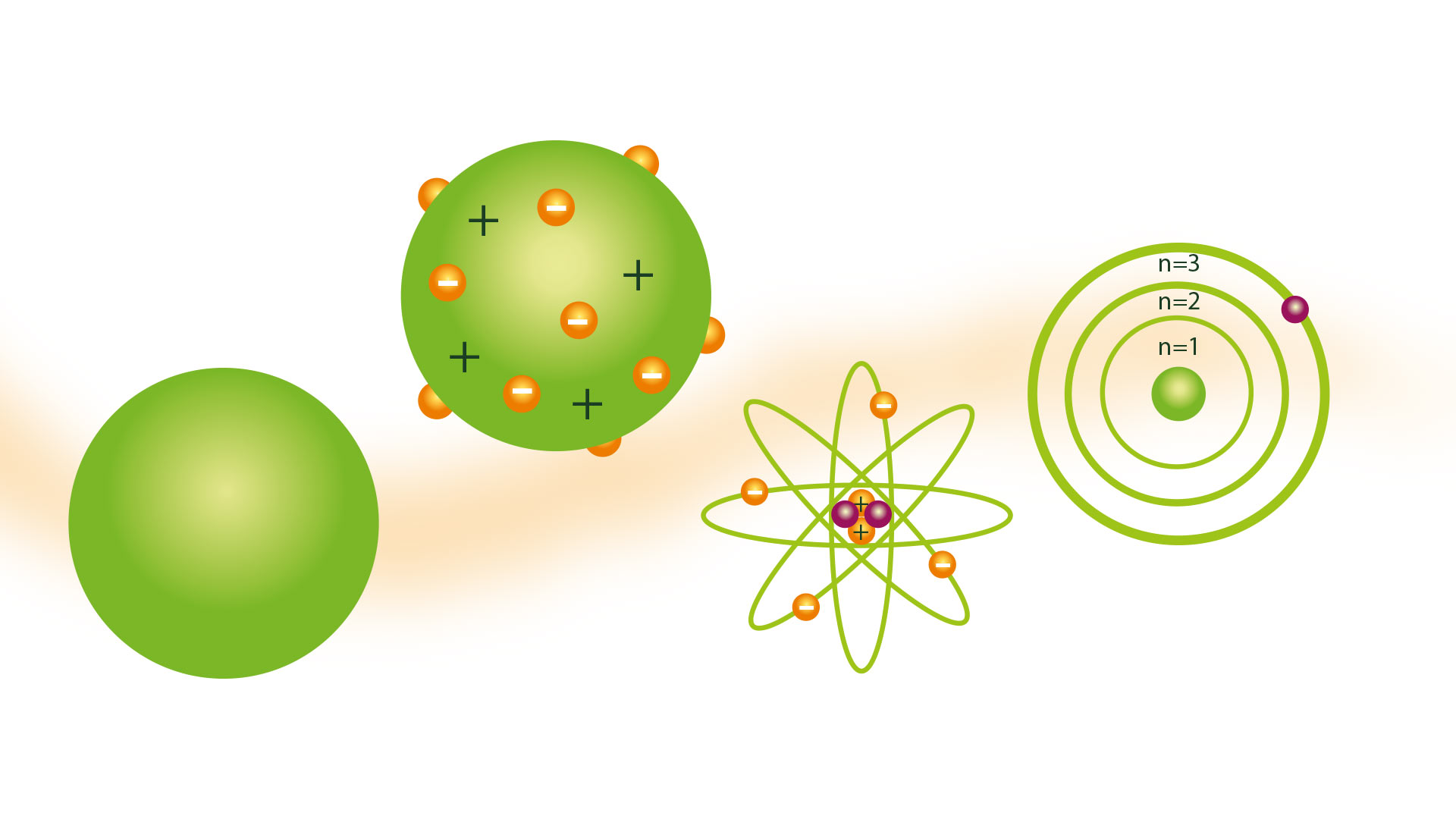
Представата за атома, представена от гръцкия философ Демокрит, не се споделя от много учени през вековете. Но през 1804 г атомен модел на Далтън, въз основа на теориите на гръцките атомисти, което беше прието.

Атомният модел на Далтън
След атомистичната мисъл и гръцките философски идеи минаха около 2 хиляди години, докато една нова атомна теория стана известна на научния свят. Произходът му е в изследванията на Джон Далтън, който е британски физик, химик и метеоролог и е промоторът на първата модерна атомна теория.
Може да се каже, че Далтън беше това, което се наричаше пълен учен, тъй като неговите изследвания не бяха ограничени до физика, напротив, той също беше широко признат с изследванията си за невъзможността да бъде в състояние да оцени цветовете от човешкото око, състояние, което благодарение на него днес е известно като далтонизъм.
Неговият атомен модел е известен като модел на билярдна топка и е представен през 1804 г. Далтън е научен изследовател и неговият модел е продуктът, до който достига след заключенията, които са резултат от множество експерименти, които извършва с газове. Той беше предшественикът на теории като Атомен модел на Ръдърфорд.
Вземайки за основа заключенията и ефектите от своята работа, Далтън успя да докаже, че атомите, за които гърците говорят, наистина съществуват, проблем, който Атомната теория на Демокрит той само бе скицирал, като успя да установи първата научно обоснована теория за съществуването на атома в историята на съвременната физика.
Основни принципи на атомния модел на Далтън
Атомният модел на Далтън е първият визуализиран опит за механизма, конформацията и местоположението на атомите, замислен между 1803 и 1807 г., Джон Далтън за първи път му дава името на атомната теория и въз основа на него прави следните предпоставки:
първи постулат
Той определи, че цялата материя е съставена от елементарни частици, наречени атоми, и не може нито да бъде разделена, нито унищожена. Те също не могат да бъдат създадени или променени в химическа реакция.
втори постулат
Атомите, които съставляват всеки елемент, са идентични един с друг, не само по тегло, но и по други характеристики. Следователно всички кислородни атоми са абсолютно равни. Вместо това атомите на различни елементи се различават един от друг по теглото си. Благодарение на този постулат възникна познанието за относителното атомно тегло чрез сравнението на различни атоми с това на водорода, което според Далтън беше най-простото.
трети постулат
Атомите не могат да бъдат разделени, без значение какъв вид химическо действие се извършва върху тях. Комбинацията от едни и същи или различни атоми ще доведе до по-сложни съединения или вещества, но винаги започвайки от атома като минималната основна единица на материята.
четвърти постулат
Комбинацията от атоми един с друг, за да се образуват съединения, винаги ще разкрива връзка, която може да бъде изразена с прости и пълни числа. Никога на дроби, тъй като атомите не могат да бъдат разделени. Това се случва с кислорода, който се образува от два равни атома (O2), или с водата, които са два равни и един различен (H2O).
пети постулат
Чрез комбиниране на атоми на произволни елементи в различни количества могат да се образуват множество различни съединения. Това е единственият начин, по който може да се обясни, че като се започне от краен брой атоми, цялата материя във Вселената е изградена. За да се илюстрира тази идея, въглероден атом и два кислородни атома ще образуват съединение (CO2), но само един от всеки елемент ще образува различно съединение (CO).
шести постулат
Всички химични съединения се образуват, когато атомите на два или повече различни елемента се съединят по постоянен и прост начин. Но, според Теорията на Далтън, атомите на един и същи елемент първоначално не проявяват никакъв афинитет един към друг, само в присъствието на различни атоми.
Законите на Далтън
В резултат на тези постулати бяха формулирани следните закони:
- Цялата материя е съставена от атоми.
- Абсолютно всичко, което е известно, се състои от атоми, както на Земята, така и в познатата Вселена. Всеки от елементите е изграден от атоми.
- Атомите са неделими и неразрушими.
- Атомите са най-малките частици на материята.
- Всички атоми на даден елемент са идентични.
- В конкретен елемент всички негови атоми имат еднаква маса и еднакви характеристики.
- Атомите на различните елементи се различават по маса и свойства.
- Всеки елемент е изграден от атоми с различни характеристики и маса.
- Съединенията са съставени от комбинация от два или повече различни вида атоми.
- Едно конкретно съединение винаги има същите видове атоми, комбинирани и в същите пропорции.
- Химичната реакция е пренареждане на атомите.
- Химическите реакции са продукт на разделяне, обединяване или пренареждане на атоми. Но атомите на един елемент никога не стават атоми на друг елемент в резултат на химическа реакция.
Допълнителни съображения за атомния модел на Далтън
Заедно със създаването на основните принципи, изброени по-горе, Далтън предложи атомите на два елемента, които са свързани един с друг, за да образуват молекули, да спазват Закона за запазване на масата. Това означава, че броят и видовете атоми, открити в една молекула, са същите като броя и видовете атоми на елементите, използвани в химическата реакция.
Друго релевантно твърдение на тази теория е Законът за множествените пропорции, според който, когато два атома от два елемента са конюгирани, конюгирането може да се случи само според съотношение на цели числа като 1:1, 2:1, 2:2 , и така нататък. Ако се вземе за пример водата, може да се види, че H2O се комбинира в съотношение 2:1, което означава, че има два водородни атома и един кислород.
Следователно не е възможно различно съотношение на тези елементи да се използва за производство на вода. Не е възможно да се произведе вода с помощта на 3 водородни атома и два кислородни атома (3:2).
Далтън също успя да създаде "Таблица на атомните тегла" и използвайки данните от тази таблица, той успя да постави елементите в подредба, определена от теглото на техните елементи, от сравнение с водорода, който е най-лекият елемент , който е първият във вашата таблица и има атомен номер 1.
Модел на билярдна топка
Следствие от идеята, че атомите са най-малките частици на материята, е да може да си ги представи като твърди и твърди сфери, за които много от неговите изображения са направени с модели, направени с дървени сфери, благодарение на които той получава билярдната топка име на модела.
Веригата на разсъжденията на теорията на Далтън успя да обясни по научно задоволителен начин два закона: Закона за постоянните пропорции, според който пропорционалността е фиксирана между реагиращите вещества, и Закона за множеството пропорции, според който пропорциите между реагиращите вещества винаги ще го прави в цели числа.
Чрез тази формулировка също беше възможно да се обясни съществуването на множество елементарни вещества, като се започне от краен набор от съставни частици. По-късно е подобрена с теорията на Ръдърфорд и Атомният модел на Бор
Атомният модел на Далтън е по същество прост комбинаторен модел, който би могъл да даде изясняване на почти цялата химия на своето време, а с това и основата за развитието и бъдещите иновации в областта на химията и в различни други области на науката.
Експериментите на Далтън
Противно на атомистите, които използваха логиката си само за концептуализиране на атома, Далтън основава твърденията си на голям брой експерименти, доказващи съществуването на атоми, извършени изцяло от гледна точка на химията. Някои от най-известните бяха:
Той провежда експерименти с материя в газообразно състояние, наблюдавайки ефектите от налягането на това състояние на материята, стигайки до заключението, че атомите, от които са съставени газообразни вещества, се намират в непрекъснато случайно движение.
Някои от неговите експерименти се основават на смес от елементи за образуване на молекули от съединения, резултатите от които му позволяват да твърди, че дадено съединение винаги ще бъде съставено от едни и същи елементи в същите пропорции и следвайки неговия Закон за множество пропорции.
Приемане на атомния модел на Далтън
Атомната теория на Далтън е широко приета от много учени от неговото време, без да е необходимо много време за това и става основа за някои раздели от днешната атомна теория.
Въпреки че днес учените също знаят, че атомите не са най-малките частици на материята, тъй като, както е известно, атомите съдържат няколко вида по-малки частици, като протони, неутрони и електрони. Теорията на Далтън веднага е установена като теоретична основа на химията.
Ограничения и грешки в теорията на Далтън
Далтън имаше хипотезата, че атомите на всички елементи остават индивидуални, поради което той не е в състояние да осъзнае, че в някои елементи атомите съществуват в молекули, какъвто е случаят с чист кислород, който съществува като O2, т.е. молекула от същия елемент с два кислородни атома.
По същия начин идеята му, че най-простото съединение между два елемента е постоянно по един атом от всеки, беше погрешна. Грешка, която го накара да заключи, че изразът за вода е HO вместо H2O.
Фактът, че оборудването, което използва, за да прави своите експерименти, е много елементарно, доведе Далтън до няколко погрешни заключения. В своето начало той даде на кислорода стойност 5.5, което означава, че той е бил 5.5 пъти по-обемист от водородния атом, който е използвал като еталон. Въпреки това той успя да коригира тези стойности години по-късно, като даде на кислорода стойност 7, въпреки факта, че други изследователи от неговото време дадоха на кислорода стойност 8.
Влияние на теорията на Далтън
Вярно е, че сегашната атомна теория е достигнала нива, които са били неописуеми преди няколко години, но генийът на Далтън е, че основните принципи на неговата теория все още са валидни в определени отношения. Днес обаче е известно, че атомите могат да бъдат разделени чрез реакции на ядрено ниво, но това не означава, че твърдението на Далтън, че те не могат да бъдат разделени с помощта на химични реакции, вече не е валидно.
Освен това днес е известно също, че не всички атоми на един и същи елемент имат една и съща маса, тъй като беше възможно да се докаже, че съществуват изотопи, които са атоми с допълнителни неутрони, и че те имат по-голяма маса дори когато е същият елемент.
Биография на Далтън
Джон Далтън е роден в Англия на 6 септември 1766 г., семейството му е скромно и ранното му образование е от родителите му и от училище в неговия град. Поради произхода си и икономическото състояние на семейството му, той трябваше да започне работа на 10-годишна възраст, като служи в къща, въпреки че се посочва също, че започва да преподава в училище на 12-годишна възраст и че на 14 става владее латински език.
Далтън продължава да преподава и получава неформални инструкции от инструктори в района, в който живее, а когато навършва 27 години, получава назначение като професор по математика и естествена философия в малък университет в Манчестър, позиция, в която продължава за няколко години 7 години, докато взема решението да стана частен преподавател по същите тези предмети.
Научни приноси
Несъмнено сред най-важните му приноси е неговата теория за атома, но Джон Далтън провежда проучвания и експерименти върху:
- Метеорология.
- Измервания на височините на планините.
- Цветна слепота, състояние, което по-късно е наречено далтонизъм в негова чест.
- Някои закони, свързани с газовете.
И той направи много други публикации на своите произведения по второстепенни теми, като тази, свързана с цвета на небето и дори по английската граматика.
Далтън беше мъж със сдържан характер и никога не се жени. Отдавайки се изключително на своите изследвания, той води скромен живот без много шум. През годините 1837 и 1838 той страда от припадъци, които доведоха до ням, но това не му попречи да продължи да разследва до годината на смъртта си през 1844 г.