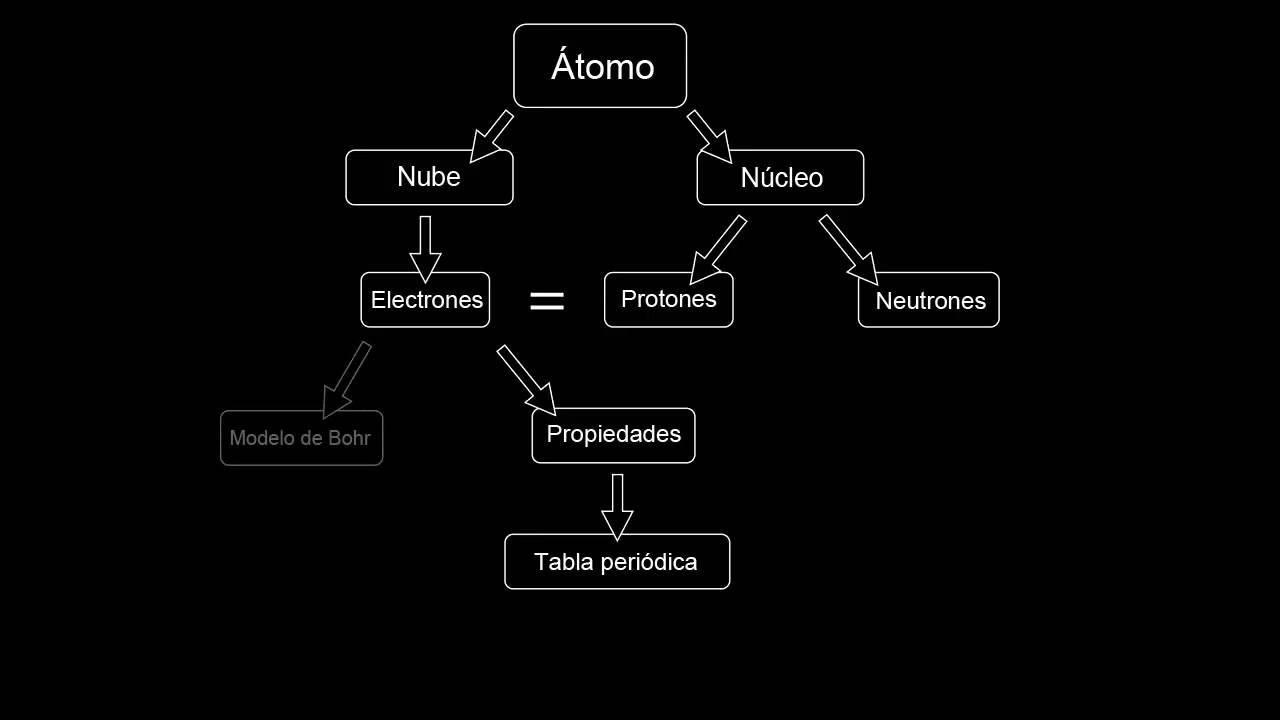
El Атомният модел на Бор опитайте се да обясните как са подредени елементите в един атом. С него беше възможно да се заключи, че движението на атомите в кръгови орбити и тяхното изместване между една орбита и друга са в състояние да предизвикат увеличаване или загуба на енергия. Тук можете да научите повече за атомната теория на Бооо

Атомен модел на Бор
Той също получи името на модела Rutherford-Bohr. Той е разработен през 1913 г. въз основа на модела на Ръдърфорд, който, макар и успешен и революционен, имаше някои конфликти със законите на Максуел и законите на Нютон, тъй като се стигна до съображението, че всички атоми са нестабилни.
Атомният модел на Ръдърфорд се основава на факта, че движещите се електрони, които имат отрицателен електрически заряд, трябва да разпространяват електромагнитно излъчване, съгласно законите на електромагнетизма. Ако приемем, че това е така, загубата на енергия би накарала електроните да компресират орбитата си, да се движат по спирала към центъра на атома и след това да колабират в ядрото.
Нови идеи
El Атомният модел на Бор даде решението на този проблем, като се аргументира, че електроните циркулират в орбита около ядрото, но само в някои разрешени орбити и с определена енергия, която е пропорционална на константата на Планк.
Тези разрешени орбити са получили името на енергийни обвивки или енергийни нива. Това означава, че енергийният капацитет на електрона вътре в атома не е непрекъснат, а се определя количествено на определено ниво.
Тези нива се идентифицират с квантово число n (n = 1, 2, 3 и повече) и според Бор това квантово число може да бъде установено с помощта на формулата на Райберг, която е правило, създадено през 1888 г. от шведския физик Йоханес Риберг за представяне на дължините на вълните на спектралните линии на много химични елементи.
Този модел на енергийни нива показва, че електроните могат да увеличат или намалят енергията си само ако успеят да прескочат от една конкретна орбита в друга и когато това се случи, електронът ще излъчва или абсорбира електромагнитно излъчване в процеса.
El Атомният модел на Бор това беше модификация на модела на Ръдърфорд. Поради тази причина се запазват особеностите на малко централно ядро с по-голямата част от масата. По същия начин електроните извършват орбиталното си движение около ядрото, подобно на планетите около слънцето, но техните орбитални движения не са плоски.
Основни принципи на атомния модел на Бор
Заредени частици с електрическа енергия с положителен знак се намират в много малки количества, ако ги сравним с обема на атома и обхващат най-голямата част от масата на атома. Докато електроните, които имат отрицателен електрически заряд, се движат около ядрото по кръгови орбити, които вече имат предварително определен размер и енергия. Поради това те не съществуват в междинно положение между орбитите.
Енергията на орбитата има връзка, пропорционална на нейния размер. Най-ниската енергия се намира в орбитата с най-малък периметър. Колкото по-далече е едно енергийно ниво от ядрото, толкова по-голямо е количеството енергия, което притежава.
Различните енергийни нива имат различен брой електрони. Колкото по-ниско е енергийното ниво, толкова по-малко електрони има. Например в ниво 1 ще има до 2 електрона, в ниво 2 ще има до 8 електрона и т.н. Така че енергията се излъчва или абсорбира в момента, в който електронът преминава от една орбита в друга.
Допълнителни съображения за атомния модел на Бор
Причината да бъде Атомният модел на Бор трябваше да обясни, че материята остава стабилна, което предишните атомни модели не направиха, както и спектрите на абсорбция и облъчване на газовете.
Бор е първият, който използва концепцията за квантуване, което я поставя между модел на класическата механика, като Приноси на Блез Паскал и квантовомеханичен модел. Той подобри модела на Ръдърфорд, като включи открития за квантуване, направени от Макс Планк няколко години по-рано, и теориите на Алберт Айнщайн.
Въпреки своите недостатъци, Атомният модел на Бор е предшественик на раждането на квантовата механика, инициирана от Шрьодингер и други учени, както и Квантовата теория на Планк.
Ограничения и грешки в модела на Бор
Моделът не обяснява защо електроните са уникално ограничени до определени орбити.
В модела беше посочено, че електроните имат известен радиус и орбита, което принципът на неопределеността на Вернер Хайзенберг ще опровергае десет години по-късно.
El Атомният модел на Бор той имаше способността да възпроизвежда поведението на електроните във водородните атоми, но неговите модели не бяха приложими за атоми на други елементи, които имат по-голям брой електрони.
Този атомен модел представя несъответствия, когато става дума за обяснение на ефекта на Зееман. Този ефект може да се види, когато спектралните линии се разделят на две или повече, в присъствието на външно и неподвижно магнитно поле.
По същия начин, Атомният модел на Бор дава погрешна стойност за орбиталния ъглов импулс на материята в основно състояние.
Всички тези причини доведоха до Атомният модел на Бор Години по-късно тя е заменена от квантовата теория, продукт на научния труд на Хайзенберг и Шрьодингер.
Кой беше Нилс Бор?
Нилс Бор е физик, роден в град Копенхаген, Дания, през октомври 1885 г. Баща му е университетски професор, а майка му е дъщеря на богато семейство. Има възможност да влезе в университета в Копенхаген през 1903 г., за да учи физика, но също така учи астрономия и математика. През 1911 г. успява да получи докторска степен.
Също така през 1911 г., благодарение на спечелването на стипендия от фондация Карлсберг, която посвети ресурсите си на изучаването на атома, той успява да пътува до Лондон и по време на престоя си се среща с подходящи учени, като Джей Джей Томсън и Ърнест Ръдърфорд.
През 1912 г. той се завръща в Дания, жени се за Маргрете Норлуд, с която има шест деца, едното от които става известен физик, който печели Нобелова награда през 1975 г., точно както баща му е направил години преди това.
Установен в Дания и поради непопулярността на физиката в страната му, той е принуден да преподава на студенти по медицина, факт, който не харесва Бор, по-късно се завръща в Манчестър, Англия, където Ръдърфорд му предлага позиция. Той остава в Лондон до 2 години след началото на Първата световна война.
Директор по физика и Нобелова награда
През 1916 г. той е назначен за директор по теоретична физика в университета в Копенхаген, което е позиция, създадена специално за него. През 1918 г. той убеждава правителството да създаде Датски институт за теоретична физика, днес известен като Институт Нилс Бор, който започва своето пътуване през 1921 г., като той е главен директор.
Той е удостоен с Нобелова награда за физика през 1922 г. за работата си в изследването на атомите и излъчваната от тях радиация. Тогава, през 1924 г., Бор се среща с Хайзенберг в Дания и по-късно има възможността да приеме учени като Пол Дирак и Ервин Шрьодингер, които успяват да оформят мисленето и интерпретацията на квантовата механика в Копенхаген.
Бор умира на 18 ноември 1962 г. в Карлсберг, Дания, но той е бащата на съвременната физика в своята страна.
Надяваме се, че това четене на Атомният модел на Бор беше интересно и ви каним да научите повече за нашето научно съдържание.